时间:2019-05-30 05:18:21
1、填空题 食盐是重要的化工原料,电解饱和食盐水的化学方程式:________________________,电解食盐水中加入了几滴酚酞试液,接通电源,阳极产生____________,以____________试纸检验,还可以看到____________极附近的溶液变红,检验阴极气体的方法是______________。将其中两种产物化合又可以得到氯化氢,属于________(强、弱、非)电解质,将其溶于水后的电离方程式为__________________。
参考答案:2NaCl+2H2O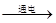 2NaOH+H2↑+Cl2↑;Cl2;湿润的淀粉碘化钾;阴;爆鸣实验;强;HCl=H++Cl-
2NaOH+H2↑+Cl2↑;Cl2;湿润的淀粉碘化钾;阴;爆鸣实验;强;HCl=H++Cl-
本题解析:电解饱和食盐水,生成氢氧化钠、氢气和氯气,2NaCl+2H2O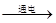 2NaOH+H2↑+Cl2↑,阴极生成氢氧化钠和氢气,阳极生成氯气,检验氯气用湿润的淀粉碘化钾试纸,氢氧化钠为强碱,遇酚酞后溶液呈红色,氢气是易燃易爆的起头,通常检验时用爆鸣实验,氢气和氯气化合可得到氯化氢气体,溶于水后生成盐酸,盐酸为强电解质,可电离生成氢离子和氯离子HCl=H++Cl-。
2NaOH+H2↑+Cl2↑,阴极生成氢氧化钠和氢气,阳极生成氯气,检验氯气用湿润的淀粉碘化钾试纸,氢氧化钠为强碱,遇酚酞后溶液呈红色,氢气是易燃易爆的起头,通常检验时用爆鸣实验,氢气和氯气化合可得到氯化氢气体,溶于水后生成盐酸,盐酸为强电解质,可电离生成氢离子和氯离子HCl=H++Cl-。
考点:点解饱和食盐水的相关知识
本题难度:困难
2、计算题 如图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn原子个数比为
A.3︰1
B.4︰1
C.2︰1
D.任意比
参考答案:A
本题解析:B极质量增加7.68g,溶液质量增加0.03g,所以合金的质量是7.71g。反应中转移电子为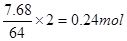 。设合金中Cu、Zn的物质的量分别为x和y,则64x+65y=7.71,2x+2y=0.24。解得x=0.09mol,y=0.03mol,所以Cu、Zn原子个数比为3︰1。
。设合金中Cu、Zn的物质的量分别为x和y,则64x+65y=7.71,2x+2y=0.24。解得x=0.09mol,y=0.03mol,所以Cu、Zn原子个数比为3︰1。
本题难度:简单
3、选择题 如图所示,X.Y都是石墨电极,a是饱和食盐水,实验开始时,同时在U型管的两边各滴入几滴酚酞试液,下列叙述正确的是?( )
A.Y是阳极,该电极附近有无色气体产生
B.电解时电能将转变为化学能
C.X是负极,该电极附近先观察到溶液变红色
D.电解一段时间收集产生的气体,Y电极得到气体体积稍大
参考答案:A、Y与原电池正极相连接,所以是阳极;溶液中的氯离子在阳极上失电子发生氧化反应,生成黄绿色的氯气,故A错误.
B、该装置是把电能转化为化学能的装置,所以是电解池,故B正确.
C、X与原电池的负极相连,所以是阴极,故C错误.
D、X电极上析出氢气,Y电极上析出氯气,因为氯气能溶于水,所以电解一段时间收集产生的气体,Y电极得到气体体积稍小,故D错误.
故选B.
本题解析:
本题难度:简单
4、选择题

参考答案:C
本题解析:
本题难度:一般
5、选择题 下列关于电解法精炼粗铜的叙述中不正确的是(?)
A.精铜板作阳极,纯铜片作阴极,CuSO4溶液作电解液
B.电解时,阳极发生氧化反应,而阴极发生的反应为: Cu2+ +2e—→Cu
C.粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥
D.电解铜的纯度可达99.95%-99.98%
参考答案:C
本题解析:略
本题难度:简单