时间:2019-05-30 05:14:28
1、选择题 除去下列溶液中的杂质(括号内是杂质)所用试剂一定不正确的是
A.NaOH溶液[Ba(OH)2]:用适量Na2SO4溶液
B.KOH溶液(K2CO3);用适量Ca(OH)2溶液
C.NaCl溶液(Na2SO4);用适量Ba(NO3)2溶液
D.HNO3溶液(HCl);用适量AgNO3溶液
参考答案:C
本题解析: NaOH溶液和Na2SO4溶液不反应,无现象;Ba(OH)2溶液和Na2SO4溶液反应产生硫酸钡白色沉淀,因此可以用Na2SO4除去杂质;适量Ca(OH)2溶液可以和碳酸钾反应生成碳酸钙沉淀和氢氧化钾,因此可以用Ca(OH)2除去杂质;硝酸钡能和硫酸钠反应生成硫酸钡沉淀和硝酸钠,然后过滤除去沉淀,但会带入新的杂质,不能够起到除杂的作用;AgNO3和HCl反应生成AgCl沉淀和HNO3,然后过滤除去沉淀且不会带入新的杂质,因此可以用HCl除去杂质
本题难度:一般
2、实验题 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量): 
(1)按照该同学设计的实验步骤,并不能得到精盐,原因在于步骤中少了一个操作,该操作是?,应加在?和?之间。
(2)判断BaCl2已过量的方法是(?)
A.取②后的上层清液少许放入试管中,再滴入几滴Na2SO4溶液,若溶液未变浑浊,则证明BaCl2已过量。
B.取②后的上层清液少许放 入试管中,再滴入几滴BaCl2溶液,若溶液未变浑浊,则证明BaCl2已过量。
入试管中,再滴入几滴BaCl2溶液,若溶液未变浑浊,则证明BaCl2已过量。
C.取②后的上层清液少许放入试管中,再滴入几滴AgNO3溶液,若溶液变浑浊,则证明BaCl2已过量。
D.取②后的上层清液少许放入试管中,再滴入几滴BaCl2溶液,若溶液变浑浊,则证明BaCl2已过量。
(3)写出④中相应的离子方程式?,?。
参考答案:(1)按照该同学设计的实验步骤,并不能得到精盐,原因在于步骤中少了一个操作,该操作是 过滤?,应加在?④?和?⑤ ?之间。
(2)判断BaCl2已过量的方法是( B?)
(3)写出⑥中相应的离子方程式? Ca2++CO32-=CaCO3↓?,
? Ba2++CO32-= BaCO3↓?。
本题解析:略
本题难度:简单
3、填空题 亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下: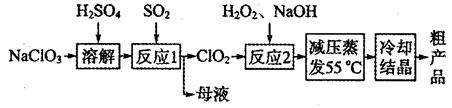
(1)提高“反应l”反应速率的措施有________________________(写出一条即可)。
(2)“反应2”的氧化剂是_____________,该反应的化学方程式为__________________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从“母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经______________(填操作名称)即可获得粗产品。
参考答案:(1)升高温度、增大吸收液浓度等;(2)ClO2? H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2;
(3)常压蒸发温度过高,亚硫酸钠容易分解;(4)Na2SO4(5)过滤
本题解析:(1)分析流程图知,反应1为SO2气体与溶液的反应,根据影响反应速率的外界条件,为提高反应速率,可升高温度、增大吸收液浓度等;(2)由流程图知,反应2为H2O2、ClO2和NaOH反应,生成NaClO2,反应中Cl元素的化合价由+4价降低为+3价,则ClO2为氧化剂,反应的方程式为H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2;(3)减压蒸发在较低温度下可进行,防止常压蒸发温度过高,亚氯酸钠容易分解,答案为:常压蒸发温度过高,亚硫酸钠容易分解;(4)氯酸钠与二氧化硫在酸性条件下发生氧化还原反应生成ClO2和Na2SO4,则母液中应含有Na2SO4;(5)冷却结晶后要从溶液中分离出固体,应用过滤的方法。
本题难度:一般
4、实验题 某同学设计提纯工业酒精的实验装置如图。请指出两处典型错误并更正 (不必再画图)。 
① _________________。
②_________________ 。
参考答案:①应使温度计水银球与蒸馏烧瓶支管口相平
②冷凝管应从下口 进水,从上口出水
本题解析:
本题难度:一般
5、选择题 下列各种仪器:①漏斗、②容量瓶、③试管、④分液漏斗、⑤天平、⑥量筒、⑦胶头滴管、⑧蒸馏烧瓶.常用于物质分离的是( )
A.①③⑦
B.①④⑧
C.②⑥⑦
D.④⑥⑧
参考答案:常用的物质分离的方法:过滤、萃取分液、蒸馏、分馏,各种方法所用的物质分离仪器分别有:漏斗、分液漏斗、蒸馏烧瓶,
故选B.
本题解析:
本题难度:简单