时间:2019-05-30 04:57:22
1、选择题 有机物大多易挥发,因此许多有机物保存时为避免挥发损失,可加一层水即“水封”,下列有机物可以用“水封法”保存的是( )
A.己烷
B.CHCl3
C.苯酚
D.酒精
参考答案:B
本题解析:己烷的密度小于水的,A不能用;B中三氯甲烷的密度大于水的,可以用;C中苯酚是固态,不能用水密封;D中酒精和水互溶,不能用,答案选B。
点评:该题是基础性试题的考查,主要是考查学生对常见化学试剂保存方法的了解掌握情况。该题的关键是明确有机物的溶解性和密度,然后灵活运用即可,有利于培养学生规范的实验操作能力。
本题难度:简单
2、实验题 (9分)I.某氯化钠固体样品中含有少量的硫酸钠和碳酸钠杂质,按下列流程进行净化,步骤如下(用于沉淀的试剂稍过量):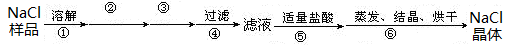
步骤②③依次加入的试剂是?。
II.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取单质碘(I2)的流程如下: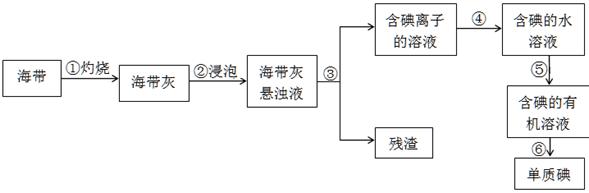
(1)①~⑥中发生化学变化的是?。
(2)步骤⑤所使用的玻璃仪器名称是?,选择的有机试剂可以是?。
A.酒精? B.四氯化碳? C.醋酸? D.苯
(3)步骤⑥从含碘的有机溶液中提取碘并回收有机溶剂,还需要经过蒸馏(如下图所示)。冷水的流向为?到?。(填A、B)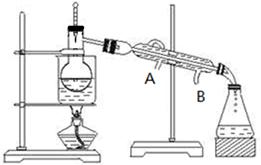
参考答案:I.? BaCl2溶液(1分) Na2CO3溶液(1分)?
II.(1)①④(2分)
(2)分液漏斗、烧杯(2分)B D(2分)
(3) B A(1分)
本题解析:I.考查物质的分离和提纯。Ca2+用碳酸钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,所以步骤②③依次加入的试剂是氯化钡溶液和碳酸钠溶液。
II.(1)海带灼烧会发生化学变化,碘离子生成单质碘的反应也化学反应,选项①④是化学变化,其余都是物理变化,答案选①④。
(2)步骤⑤是萃取,所以需要的玻璃仪器是分液漏斗、烧杯;选用的萃取剂的原则:?①和原溶液中的溶剂互不相溶;?②对溶质的溶解度要远大于原溶剂,酒精和醋酸与水都是互溶的,不能作为萃取剂,所以答案选BD。
(3)蒸馏时,气体的流向与冷却水的流向是相反的,所以冷却水的流向是B进A出。
本题难度:一般
3、选择题 下列实验中所选用的仪器合理的是
A.用200 mL量筒量取5.2 mL稀硫酸
B.用250 mL容量瓶配制250 mL 0.2 mol/L的氢氧化钠溶液
C.用托盘天平称量11.75 g氯化钠晶体
D.用碱式滴定管量取25.1 mL溴水
参考答案:B
本题解析:A不正确,应该用10ml量筒;托盘天平只能读数到0.1g,C正确;溴水显酸性,且具有腐蚀性,应该用酸式滴定管,D不正确,答案选B。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
4、选择题 下列实验叙述或操作正确的是?
A.将AlCl 溶液加热蒸干可得无水AlCl
溶液加热蒸干可得无水AlCl
B.用25 mL碱式滴定管量出14.80 mL的Na2CO3溶液
C.在中和滴定的实验过程中,目光应注视滴定管中的液面
D.用蒸馏水润湿的pH试纸测0.1mol/L的醋酸溶液的pH
参考答案:B
本题解析:略
本题难度:简单
5、实验题 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO4—+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________(填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
A.稀硫酸
B.浓硝酸
C.稀硝酸
D.稀盐酸
(3)某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)。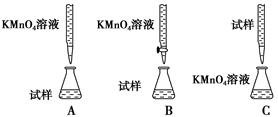
方案二 重量法 操作流程如下: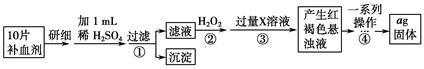
(4)步骤②中除用H2O2外还可以使用的物质是__________________________。
(5)步骤②是否可以省略________,理由是________________________________
_______________________________________。
(6)步骤④中一系列操作依次是:过滤、洗涤、________、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量________g(用含a的代数式表示)。
参考答案:(1)250 mL容量瓶 (2)A (3)B (4)氯水(等其他合理的氧化剂) (5)不能 因为Fe2+与碱反应后在空气中加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量 (6)灼烧 (7)0.07a
本题解析:(1)据题意,配制一定物质的量浓度的KMnO4溶液250 mL,还需250 mL容量瓶(必须带上容量瓶的规格)。(2)由于高锰酸钾有强氧化性不能用盐酸酸化,也不用强氧化性酸(硝酸)酸化,通常用稀硫酸酸化。(3)由于高锰酸钾有强氧化性会腐蚀橡皮管,故只能用酸式滴定管(B装置)进行滴定实验。(4)除用H2O2外还可以使用氯水氧化Fe2+,不引入新的杂质离子。(5)因为Fe2+与碱反应后在空气中加热不能得到纯净的Fe2O3,无法准确计算Fe的含量,所以必须先用H2O2氧化Fe2+来实现。(6)步骤④依次将Fe(OH)3过滤、洗涤、灼烧(Fe(OH)3分解得Fe2O3、冷却、称量。(7)每片补血剂含铁元素的质量:a g÷160 g·mol-1×2×56 g·mol-1÷10片=0.07a g/片
本题难度:一般