时间:2019-05-30 04:55:41
1、选择题 下列说法中正确的是(NA为阿伏加德罗常数)(? )
A.28 g晶体硅中含有Si—Si键的个数为2NA
B.124 g白磷(P4)晶体中含有P—P键的个数为4NA
C.12 g金刚石中含有C—C键的个数为4NA
D.SiO2晶体中每1 mol Si可与氧原子形成2NA个共价键(Si—O键)
参考答案:A
本题解析:A中,因为晶体硅和金刚石的结构一样,都是每个硅(或碳)原子与周围4个原子形成4个共价键,而依据“均摊法”,该硅(或碳)原子分得的共价键为4×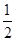 =2,所以A正确,C错误。B中,白磷是正四面体结构,每个P4分子中含有6个P—P键,故B错误。D中,SiO2晶体可由硅晶体推导而来,每个硅与周围4个氧原子形成4个Si—O键,属于该硅原子,故D错误。
=2,所以A正确,C错误。B中,白磷是正四面体结构,每个P4分子中含有6个P—P键,故B错误。D中,SiO2晶体可由硅晶体推导而来,每个硅与周围4个氧原子形成4个Si—O键,属于该硅原子,故D错误。
本题难度:一般
2、选择题 对于SO2和CO2说法正确的是(? )
A.都是直线形结构
B.中心原子都采用SP杂化轨道
C.S原子和C原子上都没有孤对电子
D.SO2为V形结构,CO2为直线形结构
参考答案:D
本题解析:
本题难度:一般
3、选择题 如图所示的是某原子晶体A空间结构的一个单元,A与某物质B反应生成C,其实质是每个A-A键中插入一个B原子,则C物质的化学式为( ? )
A.AB
B.AB4
C.AB2
D.A2B5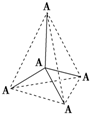
参考答案:C
本题解析:
本题难度:一般
4、选择题 有许多单质或化合物,易溶于含同一元素的盐(或酸)溶液或熔融体(或液体)中,如I2易溶于KI溶液中,S易溶于K2S溶液中,KF易溶于液态HF中,下列工业生产中应用了上述相似的溶解原理的是(?)
A.炼铁
B.炼铝
C.制发烟硫酸
D.合成氨
参考答案:B
本题解析:略
本题难度:一般
5、填空题 Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
(1)请根据XeF4的结构示意图(图1)判断这个分子是极性分子还是非极性分子?____________________。
(2)XeF2晶体是一种无色晶体,图2为它的晶胞结构图。XeF2晶体属于哪种类型的晶体?__________________。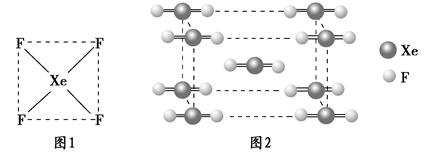
Ⅱ.已知有关物质的熔、沸点数据如下表:
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2 852 | 2 072 | 714 | 190(2.6×105Pa) |
| 沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
参考答案:Ⅰ.(1)非极性分子 (2)分子晶体
Ⅱ.(1)因为MgO的熔点远高于MgCl2,故电解熔融MgO将需要更高的温度,消耗更多的能量,因而不用电解MgO的方法生产镁。观察表中数据可见,AlCl3易升华,熔、沸点低,故属于分子晶体,不存在离子,熔融时不能导电,不能被电解,因而不能用电解AlCl3的方法生产铝
(2)将两种晶体加热到熔融状态,MgCl2能导电,AlCl3不能导电。证明MgCl2为离子晶体,AlCl3为分子晶体
本题解析:Ⅰ.(1)由图1可看出该结构为高度对称,故为非极性分子。
(2)因Xe、F都为非金属元素,且结合图2结构图得为分子晶体。
Ⅱ.(1)因为MgO的熔点远高于MgCl2,故电解熔融MgO将需要更高的温度,消耗更多的能量,因而不用电解MgO的方法生产镁。观察表中数据可见,AlCl3易升华,熔、沸点低,故属于分子晶体,不存在离子,熔融时不能导电,不能被电解,因而不能用电解AlCl3的方法生产铝
(2)区别离子晶体和分子晶体就看两晶体在熔融状态下能否导电,若能导电,则为离子晶体;若不导电,则为分子晶体。
本题难度:一般