时间:2019-05-30 04:54:27
1、选择题 下列溶液中有关物质的浓度关系正确的是
A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液:c(NH4HSO4) > c( (NH4)2SO4)> c(NH4Cl)
B.等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-) = c(HCO3-) + c(H2CO3) + c(CO32-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
参考答案:B
本题解析:A、硫酸铵中含有2个铵根离子,所以铵根离子浓度相等时,硫酸铵溶液的浓度最小,NH4HSO4中含有大量的氢离子,对铵根离子的水解起抑制作用,而氯化铵溶液中只存在铵根离子的水解,所以铵根离子浓度相等时,溶液的浓度最大的是氯化铵,所以溶液浓度: c(NH4Cl) >c(NH4HSO4) > c( (NH4)2SO4),错误;B、等物质的量的NaClO、NaHCO3混合溶液中,钠离子的物质的量浓度相等,所以根据物料守恒,则c(HClO)+c(ClO-)= c(Na+)= c(HCO3-) + c(H2CO3) + c(CO32-),正确;C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,说明醋酸的电离程度大于醋酸根离子的水解程度,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),错误;D、根据电荷守恒,则c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),错误,答案选B。
考点:考查溶液中离子浓度大小的比较,守恒规律的应用
本题难度:一般
2、填空题 (12分)次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(1)H3PO2及NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①在H3PO2中,磷元素的化合价为 ;在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4
参考答案:
本题解析:
本题难度:困难
3、选择题 常温下将0.01mol·L-1NaOH溶液与0.01mol·L-1CH3COOH溶液混合,不可能出现的结果是
A.pH>7,且c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.pH<7,且c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
参考答案:A
本题解析:
本题难度:简单
4、填空题 (8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²
参考答案:
本题解析:
本题难度:困难
5、填空题 (12分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g) 4C(g)
4C(g) 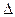 H >0 达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变条件重新达到平衡后,体系中C的质量分数增大,下列措施可行的是
H >0 达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变条件重新达到平衡后,体系中C的质量分数增大,下列措施可行的是
A、增加C的物质的量 B、加压 C、升温 D、使用催化剂
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。分析该溶液遇酚酞呈红色原因(用离子方程式表示)
(3) 在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1 mol·L-1的盐酸时,溶液中
c(Ag+) (选填“变大”、“变小”、“不变”)
参考答案:
本题解析:略
本题难度:一般