时间:2019-05-30 04:49:32
1、计算题 (5分)在一定温度下的密闭容器中存在如下反应:2SO2(g)+ O2 (g) 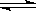 ?2SO3(g),已知c始(SO2)=0.4mol/L,c始(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19。判断:当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?(要求写出计算过程)
?2SO3(g),已知c始(SO2)=0.4mol/L,c始(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19。判断:当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?(要求写出计算过程)
参考答案:(5分)未达到平衡,向正方向进行。
本题解析:略
本题难度:简单
2、填空题 (5分)汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·mol-1,ΔS=-145 J·(mol·K)-1.
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为?
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
(2)若升高温度,则该反应的平衡常数??(填“增大”、“减小”或“不变”).
(3)判断该条件下反应?(填能、不能)自发.
参考答案:(1)B(1分) (2)减小(2分)(3)能(2分)
本题解析:略
本题难度:简单
3、填空题 (12分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g) 4C(g)?
4C(g)? H >0?达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是?;若改变条件重新达到平衡后,体系中C的质量分数增大,下列措施可行的是?
H >0?达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是?;若改变条件重新达到平衡后,体系中C的质量分数增大,下列措施可行的是?
A、增加C的物质的量? B、加压?C、升温? D、使用催化剂
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。分析该溶液遇酚酞呈红色原因(用离子方程式表示)?
(3) 在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1 mol·L-1的盐酸时,溶液中
c(Ag+)?(选填“变大”、“变小”、“不变”)
参考答案: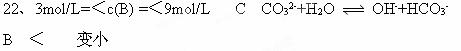
本题解析:略
本题难度:一般
4、选择题 恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g) 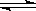 ?Na2S(s)+4H2O(g)。下列说法正确的是
?Na2S(s)+4H2O(g)。下列说法正确的是
A.该反应的平衡常数表达式K=c(H2O)/c(H2)
B.若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态
C.若Na2SO4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变
D.若初始时投入2.84gNa2SO4与一定量H2,反应达平衡时容器内固体共有2.264g,则Na2SO4的转化率为45%
参考答案:CD
本题解析:A、不正确,该反应的平衡常数表达式K=c4(H2O)/c4(H2);B、不正确,反应前后气体的体积不变,压强不变不能说明达到平衡状态;C、正确,温度不变,平衡常数不变,转化率一样;D、正确,设反应了硫酸钠xg
Na2SO4(s)+4H2(g)=Na2S(s)+4H2O(g)固体质量减少.
142g? 64g
xg? 2.84g-2.264g
x=1.278
Na2SO4的转化率=1.278g/2.84g×100%=45%,故D正确;
故选CD.
本题难度:一般
5、选择题 在一定条件下,在体积为2L的密闭容器中发生反应:mA?+?nB=pC。t秒末,A减少了1?mol,B减少了1.25?mol,C增加了0.25?mol/L。则m?∶?n?∶?p应为
A.4∶ 5∶ 2?
B.2∶ 5∶ 4 ?
C.1∶ 3∶ 2?
D.3∶ 2∶ 1
参考答案:A
本题解析:物质的变化量之比是相应的化学计量数之比,所以m ∶ n ∶ p=4∶ 5∶ 2,答案选A。
本题难度:一般