时间:2019-05-30 04:40:48
1、选择题 下列有关电解质溶液的推理中正确的是
A.室温下,pH=4的醋酸和pH=10的氢氧化钠溶液等体积混合,其pH> 7
B.pH=3的盐酸与pH=11的氨水等体积混合后,溶液中:
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.物质的量浓度相等的NH4Cl溶液和NH4HSO4溶液中,NH4+浓度相等
D.在有AgI沉淀的上清液中滴加 NaCl溶液,可以观察到白色沉淀产生
NaCl溶液,可以观察到白色沉淀产生
参考答案:B
本题解析:略
本题难度:一般
2、选择题 物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是(?)
A.Na2CO3、NaHCO3、NaCl、NH4Cl
B.NH4Cl、NaCl 、Na2CO3、NaHCO3
C.(NH4)2SO4、NH4Cl、NaNO3、Na2S
D.NH4Cl 、(NH4)2SO4、Na2S 、NaNO3
参考答案:C
本题解析: NH4Cl强酸弱碱盐水溶液显酸性,NaCl是强酸强碱盐,溶液显中性; Na2CO3和NaHCO3都是强碱弱酸盐,水解使溶液显碱性,碱性Na2CO3>NaHCO3。所以按pH由小到大顺序排列是NH4Cl>NaCl> NaHCO3> Na2CO3。因此A、B都错误。NH4Cl是强酸弱碱盐水溶液显酸性,(NH4)2SO4是强酸弱碱盐水溶液显酸性,由于盐溶液物质的量浓度相同,铵根离子的浓度:(NH4)2SO4>NH4Cl。铵根离子的浓度越大,水解得到的c(H+)就越大,溶液的酸性就越强。所以pH大小关系是(NH4)2SO4<NH4Cl。NaNO3是强酸强碱盐,溶液显中性。Na2S是强碱弱酸盐,水解使溶液显碱性。所以pH由小到大顺序排列的是(NH4)2SO4<NH4Cl< NaNO3<Na2S。因此C正确,D错误。
本题难度:一般
3、填空题 已知下列热化学方程式:①H2(g) +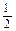 O2(g来源:91考试网 91EXAm.org)=H2O(l) ΔH="-285" kJ·mol-1
O2(g来源:91考试网 91EXAm.org)=H2O(l) ΔH="-285" kJ·mol-1
②H2(g) +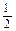 O2(g)=H2O(g) ΔH="-241.8" kJ·mol-1 ③C(s) +
O2(g)=H2O(g) ΔH="-241.8" kJ·mol-1 ③C(s) +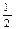 O2(g)=CO(g) ΔH="-110.5" kJ·mol-1
O2(g)=CO(g) ΔH="-110.5" kJ·mol-1
④ C(s) +O2(g)=CO2(g) ΔH="-393.5" kJ·mol-1 回答下列问题:
(1)H2的燃烧热为 ;C的燃烧热为 。
(2)燃烧1gH2生成液态水,放出的热量为 。
(3)写出CO燃烧的热化学方程式 。
参考答案:(1)285 393。5
(2)142.5
(3)CO(g)+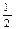 O2(g)=CO2(g) ΔH="-283" kJ·mol-1
O2(g)=CO2(g) ΔH="-283" kJ·mol-1
本题解析:略
本题难度:一般
4、选择题 室温下,PH等于2的CH3COOH溶液与PH=12的NaOH溶液等体积混合,则混合后溶液的PH值为
A.大于7或等于7
B.小于7
C.小于7或等于7
D.无法确定
参考答案:B
本题解析:CH3COOH是弱酸,部分电离,NaOH是强碱,全部电离,CH3COOH中的c(H+)等于NaOH溶液中的c(OH-)时,CH3COOH的物质的量要大于NaOH的物质的量,酸过量,溶液显酸性。
本题难度:简单
5、选择题 室温下,把1 mL 0.1 mol·L-1的H2SO4加水稀释成2 L溶液,在此溶液中由水电离产生的H+,其浓度接近于
A.1×10-4 mol·L-1
B.1×10-8 mol·L-1
C.1×10-11 mol·L-1
D.1×10-10 mol·L-1
参考答案:D
本题解析:略
本题难度:一般