时间:2019-05-30 04:37:04
1、简答题 下列物质在水中部分电离且属于电解质的是( )
A.NaOH
B.CH3COOH
C.H2SO4
D.CO2
参考答案:A.NaOH在水中能完全电离,其水溶液导电,属于电解质,故A错误;
B.CH3COOH是弱酸,在水中能部分电离,则其水溶液导电,即CH3COOH属于电解质,故B正确;
C.H2SO4是强酸,在水中能完全电离,则其水溶液导电,即硫酸属于电解质,故C错误;
D.CO2的水溶液能导电,是因二氧化碳和水反应生成碳酸,碳酸电离生成离子而导电,即发生电离不是CO2本身,故CO2属于非电解质,故D错误.
故选B.
本题解析:
本题难度:一般
2、选择题 下列关于电解质电离的叙述中,不正确的是(?)
A.电解质的电离过程就是产生自由移动离子的过程
B.碳酸钙在水中的溶解度很小,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质
C.氯气和氨气的水溶液导电性都很好,所以它们是强电解质
D.水难电离,纯水几乎不导电,所以水是弱电解质
参考答案:C
本题解析:氯气和氨气的水溶液导电是因为生成了HCl、NH3·H2O等电解质,而氯气为单质,氨气为非电解质,故C错;
本题难度:一般
3、选择题 下列各溶液中,叙述正确的是
A.0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度的大小关系:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.将0.1mol/L醋酸溶液加大量水稀释后,溶液的pH增大
D.Na2CO3溶液中:c(Na+ )="2c" (CO32- ) + c (HCO3- ) + c (H2CO3 )
参考答案:C
本题解析:A、硫酸铵是强酸弱碱盐,NH4+水解溶液显酸性,但水解程度很小,NH4+浓度大于SO42-浓度,即c(NH4+)>c(SO42-)>c(H+)>c(OH-),A不正确;B、盐酸是强酸,氨水是弱碱,因此25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合后氨水过量,溶液显碱性,溶液中离子浓度的大小关系:c(NH4+)>c(Cl-)>c(OH-)>c(H+),B不正确;C、醋酸是弱酸存在电离平衡,稀释促进电离,但溶液的酸性仍然是减小的,所以将0.1mol/L醋酸溶液加大量水稀释后,溶液的pH增大,C正确;D、根据物料守恒可知Na2CO3溶液中:c(Na+ )="2c" (CO32- ) + 2c (HCO3- ) + 2c (H2CO3 ),D不正确,答案选C。
本题难度:一般
4、选择题 下列关于强、弱电解质的叙述中,错误的是
A.强电解质在溶液中完全电离,不存在电离平衡
B.在溶液里导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同
D.纯的强电解质在液态时,有的导电,有的不导电
参考答案:B
本题解析:A.强电解质在水中完全电离,不存在电离平衡,故A正确;
B.强弱电解质与导电能力无关,取决于在水溶液中能否完全电离,故B错误;
C.弱电解质溶液的导电能力与离子的浓度和离子所带的电荷数有关,当浓度不同时,离子的浓度不同,所以导电能力不同.但当温度也不同时,弱电解质的电离程度也不同,所以当这两个因素都不相同时,导电能力可能相同,故C正确;
D.离子化合物类强电解质,液态时导电,它们都含有活泼的金属和活泼非金属,且熔点都高.如NaCl,K2SO4等,共价化合物类强电解质,液态时不导电,如AlCl3,HCl等,它们的熔点都较低,故D正确.
故选B。
点评:本题考查强弱电解质与导电能力的关系,难度不大,注意离子化合物类强电解质,液态时导电,它们都含有活泼的金属和活泼非金属,且熔点都高.如NaCl,K2SO4等,共价化合物类强电解质,液态时不导电,如AlCl3,HCl等。
本题难度:简单
5、填空题 (13分)
Ⅰ、回答下列问题
1)、已知常温下,在NaHSO3溶液中c(H2SO3 ) < c(SO32-),且H2SO3的电离平衡常数为K1=1.5×10-2
K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-2;则等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2CO3 ③KHSO3 ④KHCO3 ⑤Ba(OH)2,溶液中水的电离程度由大到小排列顺序为_____________
2)、NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘,试写出此反应的离子反应方程式_______________________________________
3)、在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是_________________,用离子方程式表示产生上述现象的原因:__________________
Ⅱ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)①在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。请写出计算过程____________________________________
参考答案:Ⅰ、 1)② ④ ① ③ ⑤ (2分)
2)、5HSO3- + 2IO3- = I2 +5SO42- +3H+ +H2O (2分)
3)H2和NH3 (2分) ; Mg+2NH4+===Mg2++2NH3 ↑+H2 ↑ (2分)
Ⅱ、(1)①Al(OH)3 (1分) ②B (1分)
(2)不含有(1分) , Fe3+完全沉淀时,c(OH-)3=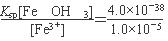 =4.0×10-33,c(Al3+)·(OH-)3=0.2×4.0×10-33=8×10-34<Ksp[Al(OH)3],所以没有生成Al(OH)3沉淀。(2分)
=4.0×10-33,c(Al3+)·(OH-)3=0.2×4.0×10-33=8×10-34<Ksp[Al(OH)3],所以没有生成Al(OH)3沉淀。(2分)
本题解析:等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2CO3 ③KHSO3 ④KHCO3 ⑤Ba(OH)2,其中②(NH4)2CO3溶于水电离出NH4+、CO32—,NH4+与CO32—水解相互促进,造成水的电离程度最大,④KHCO3溶于水电离出K+、HCO3—,HCO3—水解促进了水的电离,①、③、⑤电离均对水的电离产生抑制,且⑤为强电解质,对水的电离程度抑制最大,所以⑤中水的电离程度最小,由电离常数可知HSO3—的电离程度大于NH3·H2O的电离程度可知KHSO3对水的电离抑制程度大于NH3·H2O对水的电离的抑制程度,故这五种水溶液中水的电离程度由大到小的顺序为②>④>①>③>⑤;读题NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘可知该反应发生反应的离子为HSO3—与IO3—,IO3—被还原为I2,HSO3—被氧化为SO42—,离子方程式为:5HSO3- + 2IO3- = I2 +5SO42- +3H+ +H2O;在浓NH4Cl溶液中存在NH4++H2O NH3·H2O+H+,溶液呈酸性,加入镁单质,镁会消耗H+产生H2,使平衡右移,并且放热,NH3·H2O热稳定性差,分解为NH3和H2O,故产生气体为H2、NH3,整理的方程式为Mg+2 NH4+===Mg2++2NH3 ↑+H2 ↑;由于溶度积常数Ksp[Cu(OH)2]=2.2×10-20>Ksp[Al(OH)3]=1.1×10-33,在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成Al(OH)3沉淀,用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,则应使MgCl2、AlCl3同时接触过量的氨水,所以应先向反应器中加入氨水再滴加入MgCl2、AlCl3溶液;由于要使Fe3+完全沉淀时则c(OH-)3=
NH3·H2O+H+,溶液呈酸性,加入镁单质,镁会消耗H+产生H2,使平衡右移,并且放热,NH3·H2O热稳定性差,分解为NH3和H2O,故产生气体为H2、NH3,整理的方程式为Mg+2 NH4+===Mg2++2NH3 ↑+H2 ↑;由于溶度积常数Ksp[Cu(OH)2]=2.2×10-20>Ksp[Al(OH)3]=1.1×10-33,在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成Al(OH)3沉淀,用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,则应使MgCl2、AlCl3同时接触过量的氨水,所以应先向反应器中加入氨水再滴加入MgCl2、AlCl3溶液;由于要使Fe3+完全沉淀时则c(OH-)3=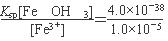 =4.0×10-33,若此时c(Al3+)=0.2 mol·L-1,则c(Al3+)·c(OH-)3=0.2×4.0×10-33=8×10-34<Ksp[Al(OH)3],所以没有生成Al(OH)3沉淀。
=4.0×10-33,若此时c(Al3+)=0.2 mol·L-1,则c(Al3+)·c(OH-)3=0.2×4.0×10-33=8×10-34<Ksp[Al(OH)3],所以没有生成Al(OH)3沉淀。
考点:难溶电解质的溶解平衡及溶度积常数应用。
本题难度:困难