时间:2019-05-30 04:32:21
1、选择题 已知100℃时,0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,该温度下将pH=8的Ba(OH)2溶液V1 L与pH="5" V2 L NaHSO4混合,所得溶液pH=7,则 V1∶V2=
A.2∶9
B.1∶9
C.1∶1
D.1∶2
参考答案:A
本题解析:0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,说明溶液中OH-的浓度也是10-10 mol·L-1,氢离子浓度是0.01mol/L,所以该温度下水的离子积常数为1×10-12。所得溶液pH=7,说明溶液显碱性,即碱是过量的,所以有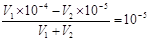 ,解得V1∶V2=2∶9,答案选A。
,解得V1∶V2=2∶9,答案选A。
本题难度:简单
2、选择题 25℃时,水的离子积为Kw,该温度下将 a mol·L-1一元酸 HA 与b mol·L-1一元强碱BOH 等体积混合,若恰好完全中和,下列结论中不正确的是
A.混合液中:c(H+ ) ≤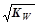
B.混合液中:c(HA)+c(A-)=a mol ·L-1
C.a = b
D.混合液中:c(H+ )+c(B+ )= c(OH-)+c(A- )
参考答案:B
本题解析:25℃时,a mol·L-1一元酸HA与bmol·L-1一元强碱BOH等体积混合后,可能是强酸和强碱反应,也可能是弱酸强碱,所以c(H+ ) ≤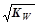 ;A选项正确,等体积混合,浓度应该减小一半,是
;A选项正确,等体积混合,浓度应该减小一半,是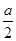 mol ·L-1,B选项错误;恰好完全中和酸碱恰好完全反应,一元酸HA与一元强碱BOH的物质的量相等,a = b ,C选项正确;根据电荷守恒,D选项正确。
mol ·L-1,B选项错误;恰好完全中和酸碱恰好完全反应,一元酸HA与一元强碱BOH的物质的量相等,a = b ,C选项正确;根据电荷守恒,D选项正确。
本题难度:简单
3、实验题 常温下,将HCl溶液和一元碱AOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 | HCl物质的量浓度(mol·L-1) | AOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.1 | c | pH=7 |
| 丙 | 0.1 | 0.1 | pH=5 |
参考答案:(1)a=7,AOH为强碱;a<7,AOH为弱碱。
(2)否;(3)10-5;
本题解析:略
本题难度:一般
4、选择题 室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液、②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是 ( )
A.通入少量HCl气体
B.加入少量NaOH固体
C.加入少量H2O
D.升高温度
参考答案:
本题解析:AA. 通入少量HCl ①NH3·H2O+HCl= NH4Cl+ H2O. c(NH4+)增大;②NH4+ H2O NH3·H2O+H+。平衡逆向移动,c(NH4+)增大。正确。B. 加入少量NaOH固体①NH3·H2O
NH3·H2O+H+。平衡逆向移动,c(NH4+)增大。正确。B. 加入少量NaOH固体①NH3·H2O NH4+OH-.平衡逆向移动,c(NH4+)减小;②NH4+ H2O
NH4+OH-.平衡逆向移动,c(NH4+)减小;②NH4+ H2O NH3·H2O+H+平衡正向移动,c(NH4+)减小。错误。C.加入少量H2O ①中的c(NH4+)减小,②中的c(NH4+)减小。错误。D. 升高温度促进①中NH3·H2O的电离,c(NH4+)增大;促进②NH4+是水解,c(NH4+)减小。错误。
NH3·H2O+H+平衡正向移动,c(NH4+)减小。错误。C.加入少量H2O ①中的c(NH4+)减小,②中的c(NH4+)减小。错误。D. 升高温度促进①中NH3·H2O的电离,c(NH4+)增大;促进②NH4+是水解,c(NH4+)减小。错误。
本题难度:一般
5、选择题 下列事实能够说明亚硝酸(HNO2)为弱电解质的是( )
A.0.1mol/L的亚硝酸水溶液的PH=2.1
B.亚硝酸不与硫酸钠溶液反应
C.25℃时,HNO2的水溶液的PH<7
D.用亚硝酸做导电实验时,灯泡很暗
参考答案:A.0.1mol/L的亚硝酸水溶液的PH=2.1,说明亚硝酸不能完全电离,为弱电解质,故A正确;
B.不符合复分解反应的条件,即使是强酸也不能与硫酸钠反应,则不能证明亚硝酸为弱电解质,故B错误;
C.25℃时,HNO2的水溶液的PH<7,只能证明呈酸性,但无法确定电离程度,不能证明为弱电解质,故C错误;
D.用亚硝酸做导电实验时,灯泡很暗,由于浓度未知,则不能证明为弱电解质,故D错误.
故选A.
本题解析:
本题难度:简单