时间:2019-05-30 04:26:10
1、选择题 下列说法正确的是
A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS)
B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大
C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体
D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀
参考答案:C
本题解析:A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),是因为难溶的向更难溶的转化。则Ksp(PbS)>Ksp(CuS)。错误。B.在NaHS溶液中,存在电离平衡:HS- H++S2-,当向其中加入少量CuCl2粉末时,发生反应:Cu2++S2-=CuS↓产生黑色沉淀,由于消耗了S2-,所以电离平衡正向移动,c(H+)增大,则pH减小。C.TiCl4是强酸弱碱盐,水解消耗水电离产生的OH-,产生Ti(OH)4.水解反应是吸热反应,所以加热条件下可促进TiCl4水解,产生更多的Ti(OH)4。然后过滤、洗涤Ti(OH)4,加热分解就可以制备TiO2固体。正确。D.铜制器皿放置过程中会生成铜绿是因为发生了反应:2Cu+O2+H2O+CO2=Cu2(OH)2CO3。错误。
H++S2-,当向其中加入少量CuCl2粉末时,发生反应:Cu2++S2-=CuS↓产生黑色沉淀,由于消耗了S2-,所以电离平衡正向移动,c(H+)增大,则pH减小。C.TiCl4是强酸弱碱盐,水解消耗水电离产生的OH-,产生Ti(OH)4.水解反应是吸热反应,所以加热条件下可促进TiCl4水解,产生更多的Ti(OH)4。然后过滤、洗涤Ti(OH)4,加热分解就可以制备TiO2固体。正确。D.铜制器皿放置过程中会生成铜绿是因为发生了反应:2Cu+O2+H2O+CO2=Cu2(OH)2CO3。错误。
本题难度:一般
2、选择题 下列说法中正确的是( )
A.等物质的量浓度NaCl和CH3COONa溶液等体积混合,
c(Cl-)>c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.25℃时,若10mL盐酸(pHa)与100mLBa(OH)2溶液(pHb)混合后恰好中和,则pHa+pHb=13
C.等物质的量浓度的硫酸与醋酸钠溶液等体积混合,c(SO42-)+c(OH-)=c(H+)+c(CH3COOH)
D.向氨水中加水稀释,
| c(N c(NH3?H2O) |
参考答案:A、等物质的量浓度NaCl和CH3COONa溶液中,醋酸根离子会水解,但是钠离子浓度应该是氯离子浓度的2倍,离子浓度之间的大小关系为:c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-)>c(H+),故A错误;
B、10mL盐酸(pHa)与100mLBa(OH)2溶液(pHb)混合后恰好中和,根据酸碱中和的实质,即氢离子和氢氧根离子等物质的量恰好反应,所以10×10-PHa=100×10PHb-14,解得pHa+pHb=13,故B正确;
C、等物质的量浓度的硫酸与醋酸钠溶液等体积混合,所得溶液中含有剩余的硫酸、生成的硫酸钠以及醋酸,根据电荷守恒:c(Na+)+c(H+)=2c(SO42-)+c(OH-)+c(CH3COO-),硫酸根浓度和钠离子浓度相等,所以c(H+)=c(SO42-)+c(OH-)+c(CH3COO-),即c(SO42-)+c(OH-)=c(H+)-c(CH3COO-),故C错误;
D、加水稀释对氨水的电离平衡向右移动,但是体积增大,所以铵根离子和一水合氨浓度均减小,但是铵根离子减小的程度小,所以c(NH+4)c(NH3?H2O)增大,故D错误.
故选B.
本题解析:
本题难度:简单
3、选择题 下列事实中能说明亚硝酸是弱电解质的是
A.用HNO2溶液作导电试验,灯光较暗
B.HNO2是共价化合物
C.亚硝酸不与氯化钠反应
D.常温下0.1 mol?L-1亚硝酸溶液的c(H+)为7.1×10-3 mol·L-1
参考答案:D
本题解析:弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就 是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在,就证明了弱电解质,据此可以判断。A、用HNO2溶液作导电试验,灯光较暗,只能说明溶液的导电性较弱,但不能说明溶液中存在电离平衡,A不正确;B、电解质的强弱与化合物是否是共价化合物无关系,例如氯化氢是共价化合物,但属于强电解质,B不正确;C、亚硝酸不与氯化钠反应,只能说明亚硝酸的酸性弱于盐酸的酸性,C不正确;D、常温下0.1 mol?L-1亚硝酸溶液的c(H+)为7.1×10-3 mol·L-1<0.1mol/L,这说明亚硝酸没有完全电离,存在电离平衡,D正确,答案选D。
本题难度:一般
4、选择题 常温下,将0.2 mol·L-1的一元酸HA溶液和0.1 mol·L-1的NaOH溶液等体积混合后,pH大于7,若混合后溶液体积等于两溶液体积之和,则下列关系中正确的是
A.[HA]<[A-]
B.[HA]一定大于0.1 mol·L-1
C.[Na+]=[HA]+[A-]
D.2[OH-]=2[H+]+[HA]-[A-]
参考答案:D
本题解析:0.2 mol·L-1的一元酸HA溶液和0.1 mol·L-1的NaOH溶液等体积混合后,生成等物质的量的NaA、HA;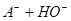

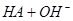 ,
,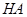

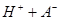 ;pH大于7,说明水解大于电离,所以[HA]>[A-] ,故A错误;[HA]一定大于0.05 mol·L-1 ,故B错误;根据物料守恒,2[Na+]="[HA]+[A-]" ,故C错误; 根据电荷守恒和物料守恒,2[OH-]=2[H+]+[HA]-[A-],故D正确。
;pH大于7,说明水解大于电离,所以[HA]>[A-] ,故A错误;[HA]一定大于0.05 mol·L-1 ,故B错误;根据物料守恒,2[Na+]="[HA]+[A-]" ,故C错误; 根据电荷守恒和物料守恒,2[OH-]=2[H+]+[HA]-[A-],故D正确。
考点:本题考查弱电解质电离和盐的水解。
本题难度:一般
5、选择题 已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2==HCN+NaNO2;NaCN+HF="=HCN+NaF" ; NaNO2+HF==HNO2+NaF?;由此可判断下列叙述中正确的是
A.HF的电离常数是①
B.HNO2的电离常数是①
C.HCN的电离常数是②
D.HNO2的电离常数是③
参考答案:A
本题解析:
正确答案:A
由三个方程式得酸性强弱顺序为:HF >HNO2> HCN
A、正确,HF酸性最强,电离常数最大;B. HNO2的电离常数是②
C. HCN的电离常数是③? D. HNO2的电离常数是②
本题难度:一般