时间:2019-05-30 04:24:12
1、填空题 在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是 。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是 。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是 。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 。
(5)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 ,反应所需时间的长短关系是 。
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是 。
参考答案:(1)b>a>c (2)b>a=c (3)c>a>b(或c>a=2b) (4)c>a=b (5)a=b=c a=b>c (6)c>a=b
本题解析:(1)氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),则当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是b>a>c;(2)同体积同物质的量浓度的三种酸,三种酸n(HCl)=n(CH3COOH)=n(H2SO4),盐酸和醋酸是一元酸,硫酸是二元酸,盐酸和醋酸需要氢氧化钠的物质的量相等,硫酸需要的氢氧化钠是盐酸和醋酸的2倍,中和NaOH能力由大到小的顺序是b>a=c;(3)氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以当三者c(H+)相同时,物质的量浓度由大到小的顺序为c>a>b;(4)当三者c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离,则分别加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b;(5)与锌反应时产生氢气的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,当c(H+)相同、体积相同时,同时加入形状、质量、密度相同的锌,则开始时反应速率的大小关系是a=b=c;反应过程中,醋酸不断电离,氢离子浓度较大,反应速率较快。反应所需时间的长短关系是a=b>c;(6)将c(H+)相同的三种酸均稀释相同倍数,盐酸、硫酸的变化相同,但醋酸为弱酸,促进电离,稀释相同的倍数时,其pH由大到小的顺序为a=b>c。
考点:考查强弱电解质的比较。
本题难度:一般
2、填空题 (本题共11分)本题有2小题。在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度A的转化率增大。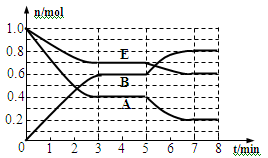
29、写出此反应的化学方程式_________________________________;此反应是___________热反应。
30、根据图数据,从反应开始到第一次达到平衡时平均速率v (E)为________________。
31、在5~7 min内曲线变化的原因可能是____(填编号)
A. 降低了温度 B. 使用了催化剂
C. 减小了容器的体积 D. 减少了A的物质的量
32、设该反应达到平衡时的平衡常数为K1,保持温度不变,将容器体积减少一半,达到新的平衡后,测得B的平衡浓度为原来的2.2倍,平衡常数为K2,则_______(填编号)
A. 平衡向正反应方向移动,且K2 > K1
B. 平衡移动过程中,正反应速率大于逆反应速率
C. 达到新平衡时,A的浓度增大,且K1 > K2
D. 达到新平衡时,E的浓度是原来的2倍多,且K1 = K2
已知在25℃时,亚硝酸、次氯酸和氢硫酸的电离常数分别为:
亚硝酸 Ki = 4.6×10-4
次氯酸 Ki = 3.0×10-8
氢硫酸 Ki 1= 9.1×10-8 Ki 2 = 1.1×10-12
33、写出氢硫酸的第一级电离平衡常数表达式:Ki1 = _________________。
34、在相同条件下,试比较H2S、HS-、HClO和HNO2的酸性强弱:______>______>_____>_______。
35、保持温度不变,在氢硫酸溶液中加入少量盐酸,下列量会变小的是_____(填序号)
A.c(S2-)
B.c(H+)
C.Kw
D.氢硫酸电离平衡常数
E.氢硫酸的电离度
参考答案:29、 2A + E 2B;放 30、 0.05 mol/(L·min)(2分) 31、 A 32、B
2B;放 30、 0.05 mol/(L·min)(2分) 31、 A 32、B
33、 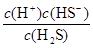 34、 HNO2>H2S>HClO>HS- (2分) 35、 A E(2分)
34、 HNO2>H2S>HClO>HS- (2分) 35、 A E(2分)
本题解析:29、根据图像可知,E、A的物质的量减少,属于反应物。B的物质的量增加,属于生成物。反应进行到3min时E减少了1.0mol-0.7mol=0.3mol,A减少了1.0mol-0.4mol=0.6mol,B增加了0.6mol,所以该反应的化学方程式为2A + E 2B;达到平衡后,降低温度A的转化率增大,这说明降低温度平衡向逆反应方向进行,所以正方应是放热反应。
2B;达到平衡后,降低温度A的转化率增大,这说明降低温度平衡向逆反应方向进行,所以正方应是放热反应。
30、从反应开始到第一次达到平衡时E的浓度减少了0.3mol÷2L=0.15mol/L,则反应速率v (E)=0.15mol/L÷3min=0.05mol/(L·min).。
31、根据图像可知在5~7 min内A、E物质的量逐渐减小,而B的物质的量逐渐增大,这说明平衡向正反应方向进行。由于正方应是体积减小的放热的可逆反应,因此曲线变化的原因可能是降低了温度,答案选A。
32、若假设该反应达到平衡时的平衡常数为K1,保持温度不变,将容器体积减少一半,压强增大,正逆反应速率均增大,平衡向正反应方向进行。A、平衡向正反应方向移动,温度不变,则K2=K1,A错误;B、平衡移动过程中,正反应速率大于逆反应速率,B正确;C、达到新平衡时,根据勒夏特列原理可知,A的浓度比原平衡时增大,但平衡常数不变,C错误;D、体积减小的瞬间,E的浓度是原来的2倍。平衡向正反应方向进行,因此达到新平衡时,E的浓度比原来的2倍小,且K1 = K2,D错误,答案选B。
33、平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据氢硫酸的电离平衡方程式可知,氢硫酸的第一级电离平衡常数表达式:Ki1 = 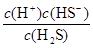 。
。
34、在相同条件下,电离平衡常数越大,酸性越强,则根据平衡常数可知H2S、HS-、HClO和HNO2的酸性强弱为:HNO2>H2S>HClO>HS-。
35、保持温度不变,在氢硫酸溶液中加入少量盐酸,氢离子浓度增大,抑制氢硫酸的电离。则A、c(S2-)减小,A正确;B、加入盐酸,c(H+)增大,B错误;C、Kw只与温度有关系,温度不变,水的离子积常数不变,C错误;D、氢硫酸电离平衡常数也只与温度有关系,温度不变,平衡常数不变,D错误;E、抑制电离,则氢硫酸的电离度减小,E正确,答案选AE。
考点:考查反应速率、平衡常数的有关判断与计算;外界条件对平衡状态的影响以及电离平衡常数的应用
本题难度:困难
3、选择题 下列电离方程式错误的是
A.NaOH=Na++OH-
B.CuSO4=Cu2++SO42-
C.H2SO4=2H++SO42-
D.KMnO4=K++Mn2+-+4O2-
参考答案:D
本题解析:略
本题难度:一般
4、选择题 在1 L 1 mol·L-1的氨水中,下列说法正确的是?(?)
A.含有1 mol NH3分子?
B.含NH3和NH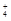 之和为1 mol?
之和为1 mol?
C.含NH3·H2O 1 mol?
D.含NH3、NH3·H2O、NH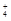 之和为1 mol
之和为1 mol
参考答案:D
本题解析:利用物料守恒 可以推出在氨水中应满足n(NH3)+ n(NH3·H2O) + n(NH 4+)="1" mol
本题难度:一般
5、选择题 将pH=11 NaOH溶液和pH=3的甲酸溶液以等体积混合后,对所得溶液,下列判断一定正确的是(?)
A.c(HCOO-)< c(Na+)
B.c(HCOO-)> c(Na+)
C.c(OH-)< c(HCOO-)
D.c(OH-)> c(HCOO-)
参考答案:BC
本题解析:略
本题难度:一般