时间:2019-05-30 04:17:38
1、填空题 合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g) 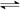 ?2NH3(g)?△H = -92 kJ·mol-1
?2NH3(g)?△H = -92 kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题: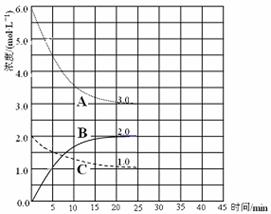
① 表示N2的浓度变化的曲线是?(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是?。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = ?(计算结果可用分数表示)。若升高温度,该反应的平衡常数值将___?____(填“增大”、“减小”或“不变”)。
(3)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(4)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ______?______。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ___?_____mol。
参考答案:(1)a c?(2)①C?②0.12 mol·L-1·min-1?③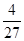 ?(或0.148、0.15); 减小
?(或0.148、0.15); 减小
(3)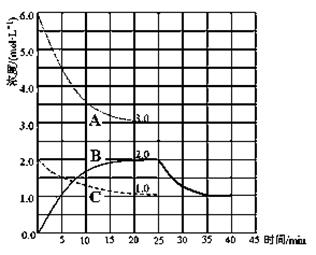
说明:对曲线的曲率不做要求,但曲线弯的方向要考虑,这涉及到浓度对反应速率的影响问题。起点与终点要正确,达平衡的时间要一致。
(4)①60%?② 2
本题解析:(1)a.该反应随反应进行,气体的总的物质的量进行,压强降低,故混合气体的压强不再发生变化,说明到达平衡, a正确;b.混合气体的总质量不变,容器的体积不变,混合气体的密度始终不变,错误。c.可逆反应到达平衡时,反应混合物各组分的浓度不发生变化,反应容器中N2的物质的量浓度不再发生变化,说明到达平衡,故c正确。d.单位时间内断开a个H-H键的同时形成3a个N-H键,都表示正反应速率,不能说明到达平衡,错误。e.反应混合物平衡时的浓度之比与起始浓度及转化率有关,平衡时可能等于化学计量数之比,也可能不等于,错误。
(2)①、N2是反应物,结合化学方程式分析,H2的曲线变化快,而N2的变化慢,所以表示N2的浓度变化的曲线是C。
②、根据v=△c÷t公式计算可得 ,前25 min 内,用H2的浓度变化表示的化学反应平均速率是0.12mol/(L·min) 。
③、平衡常数等于生应物的幂之积除以反应物的幂之积,故平衡常数K?=4/27。反应为放热反应,升高温度,反应逆向移动,故若升高温度,该反应的平衡常数值将减小。
(3)升高反应温度,平衡逆向移动,氢气的浓度增加1.5 mol·L-1,氨气减少1 mol·L-1,变为1.0mol·L-1画出曲线即可。
(4)设平衡时有x molN2转化?
N2(g)+3H2(g)) ?2NH3(g)
?2NH3(g)
起始物质的量:1mol? 3mol? 0
变化物质的量:x? 3x? 2x
平衡物质的量:1-x? 3-3x? 2x?
可得4-2x=2.8,得出x=0.6mol,α1?=60%;α1?+?α2?=1,说明这两个反应达到平衡时的状态完全相同,加入的氨气为2mol。
本题难度:困难
2、选择题 在一固定容积的密闭容器中加入2LX和3LY气体,发生如下反应:nX(g)+3Y(s) 2R(g)+Q(g)反应达到平衡时,测得X和Y的转化率分别为30%和60%,则化学方程式中的n值为
2R(g)+Q(g)反应达到平衡时,测得X和Y的转化率分别为30%和60%,则化学方程式中的n值为
[? ]
A.1
B.2
C.3
D.4
参考答案:A
本题解析:
本题难度:一般
3、选择题 在地壳内,深度每增加1km,压强约增加25250~30300kPa,这对固体物质的平衡会发生较大的影响。如:CaAl2Si2O8+Mg2SiO4 CaMg2Al2Si3O12
CaMg2Al2Si3O12
(钙长石)?(镁橄榄石)?(钙镁)石榴子石
密度(g/cm3)? 2.70? 3.22? 3.50
则在地壳区域高压条件下,有利于?(?)
A.钙长石生成
B.镁橄榄石生成
C.钙长石和镁橄榄石共存
D.(钙镁)石榴子石生成
参考答案:D
本题解析:由题意,地壳内,深度每增加1km,压强约增加25250~30300kPa,这对固体物质的平衡会发生较大的影响,即相当于有气体存在的情况下的增大压强的反应,所以,在地壳区域高压条件下平衡将向着化学计量数小的方向上移动,即有利于生成钙镁)石榴子石;正确选项为D;
本题难度:简单
4、计算题 Ⅰ.(6分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为?;2 min末时Y的浓度为?;化学方程式中n的值是________。
Ⅱ.(8分)将64g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为22.4L。请回答:
(1)NO的体积为?L,NO2的体积为?L。
(2)待产生的气体全部释放后,向溶液中加入VmL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为?mol·L-1。(用含a、V的的式子表示)
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要往其中加入25%的双氧水?g。
(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O;? NO+NO2+2NaOH=2NaNO2+H2O)
参考答案:Ⅰ.0.05mol.L-1.min-1? 0.175 mol.L-1? 4
Ⅱ. (1)11.2? 11.2? (2)(aV﹒10-3+1)/0.2? (3)136
本题解析:
Ⅰ.4X(g)+5Y(g)===nZ(g)+6W(g)? n=4
0.4mol? 0.6mol? 0? 0
0.2mol? 0.25mol? 0.2mol? 0.3mol? V(X)= 0.05mol.L-1.min-1?
0.2mol? 0.35mol? 0.2mol? 0.3mol? V(Y)=" 0.175" mol.L-1
Ⅱ.3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
xmol? 2/3xmol? Ymol? 2ymol
x+y=1? 2/3x +2y=1? x=0.75mol? y=0.25mol
2NO2+2NaOH=NaNO2+NaNO3+H2O;? NO+NO2+2NaOH=2NaNO2+H2O
由守恒法算出n(HNO3)= (aV﹒10-3+1)mol
本题难度:一般
5、选择题 常温常压下,注射器甲中装有NO2气体,注射器乙中装有相同体积的空气,注射器与U 形管连通,如图所示,打开两个止水夹,同时向外拉两注射器的活塞,且拉动的距离相等,将会看到U形管中液面(不考虑此条件下NO2与水的反应)(?)
A.a端上升,b端下降
B.a端下降,b端上升
C.U形管中液面无变化
D.无法判断
参考答案:B
本题解析:向外拉活塞时,平衡2NO2=N2O4向左移动,使甲中气体压强大于乙中气体压强,因此a端下降,b端上升,所以B正确。
本题难度:一般