时间:2019-05-30 04:14:50
1、填空题 已知某溶液中只存在OH-、H+、NH
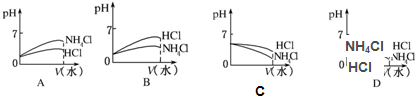
参考答案:(1)因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O?NH3.H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即①符合,
故答案为:NH4Cl;①;
(2)③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液,其溶质为NH4Cl、NH3.H2O;
④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl,
故答案为:NH4Cl和NH3?H2O;NH4Cl和HCl;
(3)pH相同的NH4Cl溶液和HCl溶液稀释时氢离子的浓度都变小,则pH都变大,但盐酸为强电解质,则pH变化程度大,而氯化铵水解显酸性,稀释促进水解,氢离子浓度减小的倍数小于盐酸中氢离子浓度的变化,则pH变化小,只有B符合题意,
故答案为:B;
(4)因体积、浓度相同的稀盐酸和氨水混合,溶液中的溶质为氯化铵,溶液显酸性,而该溶液恰好呈中性,则应为氨水与氯化铵的混合溶液,即c(HCl)<c(NH3?H2O),而HCl为强电解质,完全电离,NH3.H2O为弱电解质,不完全电离,则混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)>c(OH-),
故答案为:小于;大于.
本题解析:
本题难度:一般
2、选择题 20℃时,两种一元弱酸的钠盐NaX和NaY,已知,往NaX溶液中通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是( )
A.酸性HY>HX
B.结合H+的能力Y->CO
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列实验不能达到预期目的是( )
A.用明矾净化饮用水
B.用过滤的方法除去粗盐中的泥沙
C.用煤油保存少量的金属钠
D.用分液的方法分离酒精和水
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列溶液中有关物质的量浓度关系和计算不正确的是( )
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3)<c(CH3COONa)
B.已知25°C时KSP(AgCl)=1.8×10-10,则在0.1mol?L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol?L-1
C.25°时,0.1mol?L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol?L-1NaOH溶液中水电离出来的OH-浓度
D.室温下,0.1mol?L-1NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(H2A)>c(A2-)
参考答案:A.pH相等碱性溶液,强碱的浓度最小,则c(NaOH)最小,盐类的水解程度越小,浓度越大,由于酸性:CH3COOH>H2CO3,pH相等时,c(NaHCO3)<c(CH3COONa),故A正确;
B.c(Cl-)=0.3mol/L,c(Ag+)=1.8×10-100.3mol/L=6.0×10-10mol?L-1,故B正确;
C.盐类水解促进水的电离,而酸、碱抑制水的电离,则0.1mol?L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol?L-1NaOH溶液中水电离出来的OH-浓度,故C正确;
D.NaHA溶液的pH=4,说明电离程度大于水解程度,则c(A2-)>c(H2A),故D错误.
故选D.
本题解析:
本题难度:简单
5、选择题 下列叙述不正确的是
[? ]
A.0.1 mol/L的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
B.0.1 mol/LNa2CO3溶液中:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
C.浓度均为0.1 mol/L的碳酸钠溶液和氨水溶液中,由水电离出的c(OH-):前者大于后者
D.0.1 mol/LNH4Cl和0.1 mol/L NH3·H2O等体积混合溶液中pH>7,则:c(NH4+)>c(Cl-)>c(OH-)>
c(NH3·H2O)>c(H+)
参考答案:D
本题解析:
本题难度:一般