时间:2019-05-30 04:10:09
1、选择题 X元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中不正确的是( ? )
A.Z在一定条件下可以电离
B.Z可以表示为XY2
C.X形成+2价阳离子
D.Z的电子式为: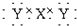
参考答案:D
本题解析:
本题难度:简单
2、选择题 有A、B、C三种短周期元素,已知A元素的原子最外层电子数等于其电子层数,B元素的原子最外层电子数是其电子层数的2倍,C元素的原子最外层电子数是其电子层?数的3倍.由这三种元素组成的化合物的化学式不可能是( )
A.A3BC4
B.A2(BC4)3
C.A2BC3
D.A2BC4
参考答案:有A、B、C三种短周期元素,所以其原子序数不大于18,;已知A元素的原子最外层电子数等于其电子层数,所以A可能是H元素、Be元素、Al元素;B元素的原子最外层电子数是其电子层数的2倍,所以B可能是He元素、C元素、S元素;C元素的原子最外层电子数是其电子层数的3倍,所以C是O元素.
ABC三种元素形成的化合物可能是含氧酸或含氧酸盐.
A、如果形成的是含氧酸或含氧酸盐,化合物中各元素的化合价代数和为0,但化合物A3BC4中各元素的化合价代数和不为0,故A错误.
B、如果形成的是含氧酸或含氧酸盐,硫酸铝符合该化学式A2(BC4)3,故B正确.
C、如果形成的是含氧酸或含氧酸盐,碳酸或亚硫酸符合该化学式A2BC3,故C正确.
D、如果形成的是含氧酸或含氧酸盐,硫酸符合该化学式A2BC4,故D正确.
故选A.
本题解析:
本题难度:一般
3、简答题 ①~⑩是元素周期表中的十种元素:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA 2 ① ② ③ 3 ④ ⑤ ⑥ ⑦ ⑧ 4 ⑨ ⑩ |
参考答案:(1)A、同主族元素从左到右原子半径逐渐减小,则有⑨>⑩,故A错误;
B、⑨和⑦离子核外电子排布相同,核电荷数越大,离子半径越小,则有⑦>⑨,故B错误;
C、根据同主族元素从上到下元素的非金属性逐渐减弱,同周期元素从左到右元素的非金属性逐渐增强,则有非金属性③>②>⑥,故C正确;
D、④和⑨为同主族金属元素,从上到下金属的熔点逐渐降低,常温下为固体,⑧和⑩为同主族非金属元素,单质的熔点从上到下逐渐增大,⑧常温下为液体,⑩常温下为固体,易升华,熔点较小,则有单质的熔点:④>⑨>⑩>⑧,故D正确;
E、同周期元素从左到右元素的非金属性逐渐增强,对应单质的氧化性逐渐增强,则有氧化性⑧>⑦,故E错误.
故答案为:CD;
(2)非金属最强的元素在表中左下角,为K元素,对应离子核内有19个质子,核外有18个电子,则离子的结构示意图为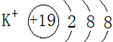 ,常温下呈液态的氢化物为H2O,O与H原子之间有1对共用电子,结构式为H-O-H,
,常温下呈液态的氢化物为H2O,O与H原子之间有1对共用电子,结构式为H-O-H,
故答案为: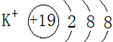 ,H-O-H;
,H-O-H;
(3)②、⑧元素形成的气态氢化物分别为NH3和HCl,相互反应的化学方程式为NH3+HCl═NH4Cl,⑨、⑤元素形成的最高价氧化物的水化物分别为KOH和Al(OH)3,相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2,
故答案为:NH3+HCl═NH4Cl;Al(OH)3+OH-═AlO2-+2H2O.
本题解析:
本题难度:一般
4、选择题 根据物质溶解性“相似相溶”的一般规律,能说明碘、溴单质在CCl4中比在水中溶解度大的是( )
A.溴、碘单质和CCl4中都含有卤素
B.溴、碘是单质,CCl4是化合物
C.Cl2、Br2、I2是非极性分子,CCl4也是非极性分子,而水为极性分子
D.以上说法都不对
参考答案:C
本题解析:Cl2、Br2、I2是非极性分子,CCl4也是非极性分子,而水为极性分子,所以根据相似相溶原理可知,碘、溴单质在CCl4中比在水中溶解度大,答案选C。
本题难度:一般
5、选择题 下列物质中,既有共价键又有分子间作用力的是?(?)
A.氦
B.氨
C.铜
D.二氧化硅
参考答案:B
本题解析:氦气是单原子分子,无共价键;铜为金属晶体,只存在金属键;二氧化硅为原子晶体,只存在共价键,而氨为分子晶体,分子间为分子间作用力,而分子内为共价键,符合题意。
本题难度:一般