时间:2019-05-30 04:02:12
1、选择题 以石墨为电极,电解含有少量酚酞和淀粉的NaI溶液。已知:通常条件下,I-的放电能力比Cl-更强。下列说法错误的是
A.阴极附近溶液呈红色
B.阴极逸出气体
C.阳极附近溶液呈蓝色
D.溶液的pH变小
2、填空题 按要求对下图中两极进行必要的连接并填空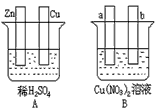
(1)在A图中,使铜片上冒H2气泡。请加以必要连接____________________,则连接后的装置叫____________。电极反应式:锌板: _______________;铜板: ___________
(2)在B图中,(a和b均为惰性电极)使a极析出铜,请加以必要的连接后,该装置叫______________。电极反应式,a极:_________________;b极:________________。在经过一段时间后,停止反应并搅均溶液,溶液的pH____________(升高、降低、不变),加入一定量的_______________后,溶液能恢复至与电解前完全一致。
3、填空题 以食盐为原料进行生产并综合利用的某些过程如下图所示。
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填序号)_____。
A.Na2CO3 B.NaOH C.BaCl2
(2)将滤液的pH调至酸性除去的离子是________。
(3)下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是________,在X极附近观察到的现象是________,电解NaCl溶液的离子方程式是_________。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是________。
4、填空题 (17分)铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,请图甲中的横线上完成标注。
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ==4OH-;
若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后,直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
5、选择题 如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,装置(丁)中Y极附近红褐色变深,则以下说法正确的是
A.电源B端是正极
B.(甲)装置的C、D电极均有单质生成,且其物质的量之比为2:1
C.欲用(丙)装置给铜镀银,H应该是银,电镀液是硝酸银溶液
D.若向(乙)中滴入酚酞溶液,在F极附近先出现红色