时间:2019-05-30 03:51:14
1、选择题 下列反应中,铁只能生成高价化合物的是
A.过量的铁与稀HNO3反应
B.铁粉与硫蒸气反应
C.铁粉与氯气反应
D.红热的铁粉与水蒸气反应
2、选择题
方案1 :向废液中加入过量的铁粉,充分反应后,过滤。?在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜。
方案1中涉及的四种阳离子的氧化牲由强到弱的顺序为:_____________________过滤操作时,需要用到的玻璃仪器是:______________________
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜作______极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_______________________________________________________?另一电极所发生的电极反应为_____________________________?方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为: ______________________
3、填空题 某氧化铁样品中含有少量的FeSO4杂质。某同学要测定其中铁元素的质量分数,他设计了如下方案进行测定,操作流程为:
请根据流程回答:
(1)操作I中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有??(填仪器名称)。
(2)操作II中必须用到的仪器是?。
A.50mL量筒
B.100mL量筒
C.50mL酸式滴定管
D.50mL碱式滴定管
(3)反应①中,加入足量H2O2溶液反应的离子方程式?。
(4)检验沉淀中SO42-是否冼涤干净的操作?
?。
(5)将沉淀物加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为blg,再次加热并冷却至室温称量其质量为b2g,若b1—b2=0.3,还应进行的操作是?
?。
(6)若坩埚的质量为42.6g,最终坩埚与加热后同体的总质量为44.8g,则样品中铁元素的质量分数=?(保留一位小数)。
(7)另一同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水后充分搅拌,加热蒸干灼烧称量即可,请你评价他的这个方案是否可行??。(填“可行”或“不可行”)
4、简答题 (15 分)废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下: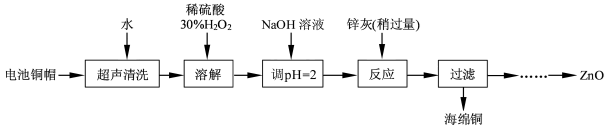
(1)①铜帽溶解时加入H2O2的目的是?(用化学方程式表示)。②铜帽溶解完全后, 需将溶液中过量的H2O2除去。除去H2O2的简便方法是?。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2? 2S2O32- +I2=2I-+S4O62-
①滴定选用的指示剂为?,滴定终点观察到的现象为?。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会?(填“偏高”、“偏低”或“不变”)。
(3)已知pH>11 时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 mol·L-1计算)。
| ? | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Fe2+ | 5. 8 | 8. 8 |
| Zn2+ | 5. 9 | 8. 9 |
5、实验题 (6分)某化学兴趣小组用铁矿石(主要成分为Fe203,还有Si02、A1203
等杂质)提取Fe2O3。操作讨程如下: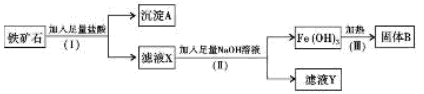
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是?;
(2)沉淀A中主要含有?,固体B是?;
(3)滤液Y中的阴离子除OH-、Cl-外,还有?;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式?