时间:2019-05-30 03:27:56
1、选择题 常温常压下,将a mol CO2气体通入1L 1 mol/L的NaOH溶液中,下列对所得溶液的描述不正确的是
A.当a=0.5时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
B.当0.5c(CO32-)+ c (HCO3-)+ c (H2CO3)
C.当a=1时,所得溶液中存在:c(CO32-)+c(OH-)= c (H+)+ c (H2CO3)
D.当a=1时,所得溶液中存在:c(Na+)> c (CO32-)>c(HCO3-)>c(OH-)>c(H+)
2、填空题 (14分)完成下列各题:(1).在 时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g)
时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g) 2NH3(g);
2NH3(g);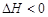 ,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
①该反应在0~10min时间内H2的平均反应速率为 N2的转化率为
②在 时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为( )(填选项字母)
时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为( )(填选项字母)
a 大于0.4mol b 等于0.4mol c 小于0.4mol
③下图是在 时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在
时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在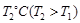 时的H2体积分数随时间t的变化曲线。
时的H2体积分数随时间t的变化曲线。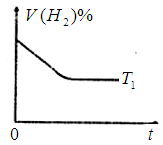
(2).已知:Al3 +与HCO3
3、选择题 下列溶液加热蒸干后,能析出溶质固体的是
A.Fe2(SO4)3
B.KHCO3
C.AlCl3
D.NH4HCO3
4、填空题 (10分)(1)写出稀硫酸与硫代硫酸钠溶液混合的离子方程式
(2)向FeCl3稀溶液中滴加少量KSCN稀溶液,离子方程式为
(2)若再向其中滴加少量硫氰化铵或硫酸铁浓溶液,现象是
(3)实验室配制FeCl3溶液的方法是:
(4)滴有酚酞试液的Na2CO3溶液显_______色,若给溶液加热,溶液颜色会_________,其原因是_____________________________________________(用方程式结合必要的文字回答)
5、选择题 等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是
A.NH4Cl
B.NH4HCO3
C.NH3·H2O
D.NH4HSO4