时间:2019-05-30 03:26:23
1、选择题 检验某溶液中是否含有Cl-,正确的操作是
[? ]
A.取样,滴加AgNO3溶液,看是否有白色沉淀生成
B.取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成
C.取样,先加稀H2SO4酸化,再加入AgNO3溶液,看是否有白色沉淀生成
D.取样,加少量AgNO3溶液,有白色沉淀,再加稀HNO3,看白色沉淀是否消失
参考答案:D
本题解析:
本题难度:一般
2、选择题 必须通过加入其它试剂才能鉴别的一组无色溶液是( )
A.氯化铝溶液和氢氧化钾溶液
B.碳酸氢钠和稀盐酸
C.偏铝酸钠溶液和稀硝酸
D.碳酸钠和稀硫酸
参考答案:A.试剂加入顺序不同,现象不同,KOH滴入氯化铝中先生成沉淀后沉淀溶解,氯化铝滴入KOH中先没有沉淀后生成沉淀,可以鉴别,故A不选;
B.改变试剂的顺序,均发生反应生成氯化钠、水、二氧化碳,则必须通过加入其它试剂才能鉴别,故B选;
C.硝酸过量时,不生成沉淀,偏铝酸钠中滴加硝酸,先生成沉淀后沉淀现象,可以鉴别,故C不选;
D.碳酸钠中滴加硫酸,先不生成气体后生成气体,而硫酸中加碳酸钠开始就生成气体,现象不同,可鉴别,故D不选;
故选B.
本题解析:
本题难度:简单
3、简答题 加过量的稀盐酸,产生无色、无味的气体,溶液里一定含有大量的CO32-.______(判断对错正确的打“√”,错误的打“×”)
参考答案:加过量的稀盐酸,产生无色、无味的气体,溶液里可能含有大量的CO32-,也可能含有HCO3-,
要确定是否含有CO32-,可以再取少量的待测液加入CaCl2溶液,若出现白色沉淀证明有大量的CO32-,否则溶液中含有大量的HCO3-,
这种说法错误,
故答案为:×.
本题解析:
本题难度:一般
4、填空题 有一无色溶液,可能含有Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种。为分析其成分,分别进行了四个实验,其操作和有关现象如图1所示: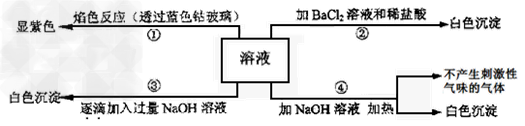
图1
已知:第③个实验中,生成白色沉淀的量与加入NaOH的量有图2所示关系。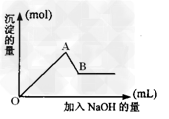
图2
⑴、在原溶液中一定存在的离子有?_____?,一定不存在的离子有?____?。
⑵、要配成该溶液,一般可在水中溶解常见的两种物质,它们分别是?_____?和?____?。(写化学式)
⑶、写出第③个实验中如图2之AB段发生反应的离子方程式?___________________?。
参考答案:⑴、Al3+、Mg2+、K+、SO42-;Fe2+、Cu2+、NH4+、CO32-?
⑵、MgSO4,KAl(SO4)2
⑶、Al(OH) 3 + OH- =?AlO2-+ 2H2O
本题解析:
本题难度:一般
5、实验题
某钠盐溶液可能含有阴离子NO3-,CO32-,SO32-,SO42-,Cl-,Br-,I-。为鉴定这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体。该气体能使饱和石灰水溶液变浑浊;
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由。
实验① ________________________________________
实验② ________________________________________
实验③ ________________________________________?
实验④ ________________________________________?
实验⑤ ________________________________________?
(2)上述5个实验不能确定是否存在的离子是____________________________
参考答案:(1)①CO32-和SO32-可能存在,因它们水解呈碱性
②CO32-肯定存在,因产生的气体是CO2;SO32-不存在,因为没有刺激性气味的气体产生
③Br-、I-不存在,因没有溴和碘的颜色出现
④SO42-存在,因BaSO4不溶于盐酸
⑤Cl-存在,因与Ag+形成白色沉淀
(2)NO3-
本题解析:
本题难度:一般