时间:2019-05-30 03:24:57
1、选择题 下列离子方程式中正确的是
A.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++OHNH3↑+H2O
C.稀硝酸和过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
D.KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+=2H2O+I2
参考答案:D
本题解析:分析:A.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性生成硫酸钡、硫酸钠、水;
B.漏写碳酸氢根离子与碱的反应;
C.稀硝酸和过量的铁屑反应生成硝酸亚铁、NO、水;
D.KI溶液与H2SO4酸化的H2O2溶液混合发生氧化还原反应生成水、碘、硫酸钾.
解答:A.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故A错误;
B.NH4HCO3溶液与过量KOH浓溶液共热的离子反应为HCO3++NH4++2OH NH3↑+H2O+CO32-,故B错误;
NH3↑+H2O+CO32-,故B错误;
C.稀硝酸和过量的铁屑反应的离子反应为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故C错误;
D.KI溶液与H2SO4酸化的H2O2溶液混合的离子反应为2I-+H2O2+2H+=2H2O+I2,故D正确;
故选D.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,并注意离子反应方程式的书写方法来解答,题目难度不大.
本题难度:简单
2、选择题 由乙醛和乙酸乙酯组成的混合物中,已知氢元素占总质量的1/11,则氧元素占总质量的
A.10/11
B.4/25
C.4/11
D.4/5
参考答案:C
本题解析:根据乙醛和乙酸乙酯的分子式C2H4O和C4H8O2可知,碳和氢原子的质量之比始终是6︰1的,所以碳元素的质量分数6/11,因此氧元素的质量分数为1-1/11-6/11=4/11,答案选C。
本题难度:困难
3、选择题 铁片投入下列溶液,溶液质量增加,但无气体产生的是
A.盐酸
B.Cu(NO3)2溶液
C.稀硫酸
D.FeCl3溶液
参考答案:D
本题解析:分析:A、铁与盐酸反应生成氯化亚铁和氢气,56gFe反应溶液增加(56-2)=54g,溶液质量增加,但生成了气体;
B、铁与硝酸铜溶液反应置换出铜,56gFe反应溶液质量减少(64-56)=8g,溶液质量减小;
C、铁与稀硫酸反应,56gFe反应溶液增加(56-2)=54g,溶液质量增加,但生成了气体;
D、铁与FeCl3反应,生成Fe2+,溶液质量增加,且没有气体产生.
解答:A、铁与稀盐酸反应,化学方程式为:Fe+2HCl═FeCl2+H2↑,56gFe反应溶液增加(56-2)=54g,溶液质量增加,但生成了气体,故A不选;
B、铁与硝酸铜反应,化学方程式为:CuSO4+Fe═FeSO4+Cu,56 gFe反应溶液质量减少(64-56)=8g,溶液质量减小,故B不选;
C、铁与稀硫酸反应,化学方程式为:Fe+H2SO4═FeSO4+H2↑,56gFe反应溶液增加(56-2)=54g,溶液质量增加,但生成了气体,故C不选;
D、铁与氯化铁反应,化学方程式为:Fe+2FeCl3═3FeCl2,该反应为化合反应,56gFe反应溶液增加,溶液质量增加,且没有气体生成,故D选;
故选D.
点评:本题考查铁及其化合物的性质,铁可以和非氧化性酸如盐酸、稀硫酸反应生成气体,把不活泼金属从它的盐溶液中置换出来,本身生成Fe2+,与强氧化性物质如氯气反应生成Fe3+.
本题难度:困难
4、选择题 分子式为C9H10O2,能与NaHCO3溶液反应放出CO2气体,且苯环上的一氯代物有两种的有机物有(不考虑立体异构)
A.3 种
B.4 种
C.5 种
D.6 种
参考答案:B
本题解析:试题分析:能与NaHCO3溶液反应放出CO2气体,说明分子中含有羧基。苯环上的一氯代物有两种,说明苯环上至少含有2个取代基。如果含有2个取代基,则可以是-CH2CH3和-COOH,或-CH3和-CH2COOH,且位置只能是对位;如果含有3个取代基,则应该是2个甲基、1个羧基,其结构简式可以是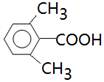 或
或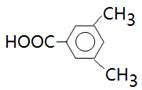 ,所以共计是4种,答案选B。
,所以共计是4种,答案选B。
考点:考查同分异构体的判断
本题难度:困难
5、选择题 下列反应的离子方程式书写正确的是
A.过量的铁与浓硝酸反应:Fe+6H++3NO3-=Fe3+?十3NO2↑+3H2O
B.次氯酸钙溶液中通入过量CO2:ClO-+CO2+H2O=HClO+HCO3-
C.1mol?L-1?的?NaAlO2?溶液和2.5mol?L-1?的盐酸等体积混合:2AlO2-+5?H+=Al(OH)3↓+Al3++H2?O
D.在碳酸氢镁溶液中加入足量Ca(OH)2?溶液:Mg2++2HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O
参考答案:BC
本题解析:分析:A.过量的铁会和+3价的铁离子发生氧化还原反应生成+2价的铁离子;
B.碳酸的酸性比次氯酸强,碳酸钙和二氧化碳和水反应生成易溶于水的碳酸氢钙;
C.NaAlO2?溶液和盐酸混合,生成氢氧化铝沉淀,当盐酸过量时,生成的氢氧化铝溶解;
D.碳酸镁的溶解度比氢氧化镁的溶解度大,在足量的氢氧根溶液中,镁离子应以氢氧化镁的形式沉淀;
解答:A.该选项中的离子反应方程式为少量的铁与浓硝酸的反应.当铁过量时,铁具有还原性,+3价的铁离子具有氧化性,Fe+2Fe3+═3Fe2+,过量的铁与浓硝酸反应:Fe+4H++2NO3-=Fe2+?十2NO2↑+2H2O,故A错误;
B.次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓,继续通二氧化碳至过量,CaCO3++CO2+H2O=Ca2++2HCO3-,两反应式相加除以2,得次氯酸钙溶液中通入过量CO2:ClO-+CO2+H2O=HClO+HCO3-,故B正确;
C.设取1升溶液,1mol?L-1?的?NaAlO2?溶液和2.5mol?L-1?的盐酸分别含偏铝酸钠和盐酸分别为:1mol,2.5mol,根据反应:NaAlO2+HCl+H2O═NaCl+Al(OH)3↓①,Al(OH)3+3HCl═AlCl3+3H2O②,按①反应的偏铝酸钠和盐酸分别为:1mol、1mol,同时生成1mol氢氧化铝,按②反应的盐酸和氢氧化铝分别为1.5mol、0.5mol,最终剩余0.5mol的氢氧化铝,生成0.5mol的氯化铝,总反应为:2AlO2-+5?H+=Al(OH)3↓+Al3++H2O,故C正确;
D.MgCO3微溶于水,Mg(OH)2难溶于水,在碳酸氢镁溶液中加入足量Ca(OH)2?溶液,反应为:2Ca2++Mg2++4OH-+2HCO3-=Mg(OH)2↓+2CaCO3↓+2H2O,故D错误;
故选BC.
点评:该题主要考查了当反应物的量不同时,发生的反应不同,反应方程需根据反应的量来定,做题时,需关注反应物的物质的量.
本题难度:困难