时间:2019-05-30 03:22:28
1、选择题 在a、b两支试管中加入体积相同的同种生铁块。在a中加入食盐水,塞上橡皮塞,如图。U型玻璃管内为红墨水(开始时两端液面等高)。放置一段时间后,下列叙述错误的是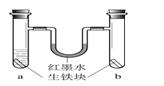
A.生铁块中的主要成分是铁,也含有少量的碳
B.红墨水柱两边的液面变为左低右高
C.两试管中铁均被锈蚀
D.a试管中发生的反应是:2C+2Fe+3O2=2FeCO3
参考答案:BD
本题解析:略
本题难度:简单
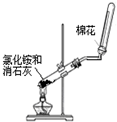
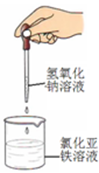
2、选择题 下列药品和装置合理且能完成相应实验的是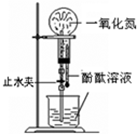 ?
? ?
? ?
?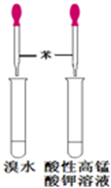
A?B?C? D
A.喷泉实验
B.实验室制取并收集氨气
C.制备氢氧化亚铁
D.验证苯中是否含有碳碳双键
参考答案:D
本题解析:A、NO与水不反应,且不溶于水,不能形成喷泉,故A错误;B、为防止试管炸裂,应将试管口应向下倾斜,故B错误;C、氢氧化亚铁易与空气中氧气反应而变质,应在氯化亚铁的溶液中滴加几滴苯,并将滴管插入到液面以下,故C错误;D、加入溴水和酸性高锰酸钾,观察现象,如苯与溴水和酸性高锰酸钾都不褪色,说明不反应,则苯中不含碳碳双键,可达到实验目的,D正确,答案选D。
本题难度:一般
3、实验题 (15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白: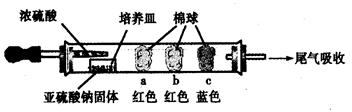
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | ? | 棉球变白,微热后又恢复红色 | ? |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:? |
| c | ? ? | 棉球变为白色 | 该气体具有??(选填“氧化性”或“还原性”) |
参考答案:Ⅰ
棉球
棉球上滴加的试剂
现象
解释和结论
a
品红试液
?
SO2具有漂白性,且为暂时性漂白
b
?
?
离子方程式:2OHˉ+ SO2 = SO32ˉ+ H2O 或OHˉ+SO2=HSO3ˉ?
c
含淀粉的碘水
?
? 还原??性
Ⅱ、实验一:(3)在C装置出口处收集H2并验纯后(2分)? (5)24%(2分)
实验二:(1))烧杯、玻璃棒(2分)(2)bc(2分)
实验结论: Fe5O6(2分)
本题解析:Ⅰ、a、品红试液是红色的,二氧化硫能使品红褪色,漂白原理是:SO2与品红反应生成无色不稳定物质,遇热分解又生成SO2和品红,又恢复红色;
b、氢氧化钠遇到酚酞也是红色的,二氧化硫能和氢氧化钠反应导致红色消失,反应原理是:SO2+OH-=HSO3-;
c、碘单质遇到淀粉变为蓝色,二氧化硫能将碘单质还原为碘离子,SO2+I2+2H2O=H2SO4+2HI,从而使蓝色消失;
Ⅱ、实验一:(1)(2)测的反应后装置B增重2.70g,根据反应的实质,增加的是氧元素的质量,所以氧元素的质量分数是: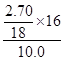 ×100%=24%,
×100%=24%,
故答案为:24%;
实验二:(2)a、滴定管用蒸馏水洗涤后必须用标准液润洗,故a错误;
b、锥形瓶不需要用待测液润洗,故b错误;
c、碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故c正确;
由实验一,n(H2O)=2.7g/18g/mol=0.15mol
H2?~ H2O ?~?O
0.15mol? 0.15mol
由实验二, 2Fe3++2I-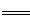 2Fe2++I2?Fe3+?~? I-
2Fe2++I2?Fe3+?~? I-
?0.5×0.02? 0.5×0.02
n(Fe3+)=0.5mol/L×0.25L=0.125mol?
Fe3+?~?Fe
0.125mol? 0.125mol
所以n(Fe):n(O)=0.125mol:0.15mol=5:6
本题难度:困难
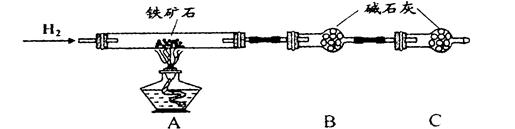
4、填空题 工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下: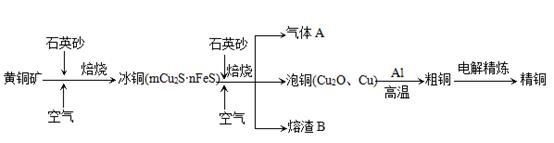
(1)气体A中的大气污染物可选用下列试剂中的_______
a.浓H2SO4 ?b.稀HNO3? c.NaOH溶液? d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在?(填离子符号),检验溶液中还存在Fe2+的方法是 ??(注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为?。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是?。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为?。
参考答案:(1)cd
(2)Fe3+?取少量溶液,滴加KMnO4溶液,KMnO4溶液褪色(其它答案只要合理)
(3)3Cu2O+2Al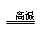 Al2O3+6Cu?
Al2O3+6Cu?
(4)bd?
(5)4H++O2+4e-=2H2O
本题解析:(1)气体A中的大气污染物主要含二氧化硫,需用碱性溶液吸收,答案选cd。
(2)滴加KSCN溶液后呈红色,说明存在Fe3+。证明Fe2+的方法一般是用酸性高锰酸钾溶液,使其褪色证明存在Fe2+,具体操作取少量溶液,滴加KMnO4溶液,KMnO4溶液,其现象是酸性高锰酸钾溶液褪色。
(3)由泡铜冶炼粗铜是用铝单质还原Cu2O,发生的化学方程式为
3Cu2O+2Al Al2O3+6Cu
Al2O3+6Cu
(4)粗铜的精炼中粗铜做阳极,发生氧化反应,纯铜做阴极,与外接电源负极相连,发生还原反应,在电解池中阳离子向阴极移动,在电解过程中还伴随着热量放出,所以电能不可能全部转化为化学能。选择bd。
(5)原电池中正极发生还原反应,元素化合价降低,在
2Cu+O2+2H2SO4=2CuSO4+2H2O中,氧气发生还原反应,所以电极反应式为,4H++O2+4e-=2H2O。
本题难度:一般
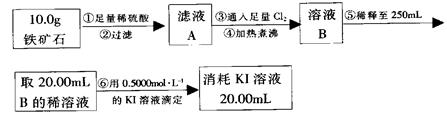
5、实验题 绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
查询资料,得有关物质的数据如下表:
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
参考答案:
(1)AD ?
(2)除去溶液中的Sn2+离子,并防止Fe2+被氧化;防止Fe2+离子生成沉淀
(3)蒸发浓缩;过滤洗涤
(4)降低洗涤过程中FeSO4·7H2O的损耗
(5)①酸式滴定管
②滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色。
③0.975
本题解析:(1)检验Fe3+通常用KSCN溶液,加入KSCN溶液,溶液显血红色;Fe3+加入苯酚溶液,溶液显紫色,据此也可检验Fe3+。
(2)通入H2S可以使Sn2+完全沉淀,S2-具有还原性,还可以防止Fe2+被氧化。根据题中数据,将溶液酸化至pH=2,目的是只沉淀Sn2+,防止Fe2+沉淀。
(3)从溶液中得到晶体的操作一般为蒸发浓缩、冷却结晶、过滤洗涤。
(4)用冰水洗涤一方面可以出去杂质,另一方面降低FeSO4·7H2O的溶解度,减小洗涤过程中的损失。
(5)①盛放酸性高锰酸钾溶液应用酸式滴定管。
②高锰酸钾溶液有颜色,滴入最后一滴时,溶液显浅红色,且半分钟不褪色,则达到终点。
③根据关系式5Fe2+~KMnO4,可知样品中所含FeSO4·7H2O的物质的量为0.01000mol/L×0.02L×5×10=0.01mol,故样品中FeSO4·7H2O的质量分数为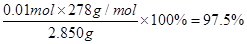 。
。
本题难度:一般