时间:2019-05-30 03:20:05
1、填空题 已知:A是硫酸盐,且A和G、C和D、F和H元素组成相同。G和KSCN溶液混合后溶液显血红色。反应过程中产生的水在图示中已略去。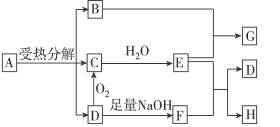
完成下列问题:
(1)写出G和H的化学式:G_____________,H_____________。
(2)工业生产中D转化为C的反应条件是:_____________。
(3)B跟E反应的离子方程式是_____________。
参考答案:(1)Fe2(SO4)3? Na2SO4
(2)催化剂和适当的温度
(3)Fe2O3+6H+====2Fe3++3H2O
本题解析:G与KSCN溶液混合后溶液显血红色,说明G中含有Fe3+。因为A为硫酸盐,且A和G组成元素相同,所以G为Fe2(SO4)3,推测A为FeSO4。D为A的分解产物且D与O2、NaOH溶液均能起反应,因此D为具有还原性的SO2气体,依次推出C为SO3、E为H2SO4、F为Na2SO3、H为 Na2SO4、B为Fe2O3。框图中B与E反应的离子方程式为Fe2O3+6H+====2Fe3++3H2O;D转化为C的化学方程式为2SO2+O2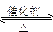 2SO3,接触法制H2SO4时,该反应的适宜条件是V2O5作催化剂,温度控制在450 ℃左右,因此工业生产中该反应的适宜条件为催化剂和适当的温度。
2SO3,接触法制H2SO4时,该反应的适宜条件是V2O5作催化剂,温度控制在450 ℃左右,因此工业生产中该反应的适宜条件为催化剂和适当的温度。
本题难度:简单
2、选择题 下列关于铁的叙述正确的是
①铁能被磁铁吸引,但纯铁易锈蚀?②在人体的血红蛋白中含有铁元素③铁是地壳中含量最高的金属?④铁能在氧气中剧烈燃烧,但不能在水蒸气中反应?⑤能通过化合反应生成FeCl3和Fe(OH)3
A.①③
B.②④
C.②⑤
D.④⑤
参考答案:C
本题解析:
正确答案:C
①不正确,铁能被磁铁吸引,但纯铁抗蚀性很强?②正确;③不正确,铝是地壳中含量最高的金属?④不正确,铁能在氧气中剧烈燃烧,也能在水蒸气中反应生成Fe3O4和H2?⑤正确。能通过化合反应生成FeCl3和Fe(OH)3,2Fe+3Cl2=2FeCl3,4Fe(OH)2+O2+2H2O="4Fe" (OH)3
本题难度:一般
3、填空题 实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下: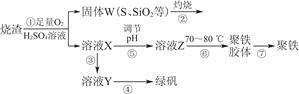
(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液 ? B.紫色石蕊溶液
C.酸性KMnO4溶液 ? D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为______________________________
(3)过程③中,需加入的物质是________。
(4)过程④中,蒸发结晶需要使用酒精灯、三脚架、泥三角,还需要的仪器有________________。
(5)过程⑤调节pH可选用下列试剂中的________(填选项序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80 ℃,目的是______________________。
参考答案:(1)ACD
(2)4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S
(3)Fe(或铁) (4)蒸发皿、玻璃棒 (5)B
(6)促进Fe3+的水解
本题解析:(1)过程②中产生的气体是SO2,具有漂白性(能使品红溶液褪色);SO2对酸碱指示剂没有漂白作用。
(2)FeS化合价升高为1+2=3, O2 化合价降低4,两者个数比是4∶3,再结合原子守恒配平。
(3)过程③中加入铁将Fe3+还原为Fe2+,又不引入杂质。
(4)蒸发溶液时将液体放在蒸发皿中,并不断用玻璃棒搅拌。
(5)中和过量硫酸,选择CaCO3固体,若选择NaOH 溶液,则易使Fe3+沉淀。
(6)升高温度,促进Fe3+的水解。
本题难度:一般
4、选择题 在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是? ( )
A.最后得到的溶液中含有Fe3+
B.残余固体可能为铁、铜混合物
C.最后得到的溶液中只含Cu2+
D.残余固体一定全部是铜
参考答案:B
本题解析:本题涉及的反应有:(1)Cu+2Fe3+==Cu2++2Fe2+,(2)Fe+Cu2+==Fe2++Cu,所以C不正确;由于题目中b<c,说明所加的Fe的量不确定,若Fe的量不足,说明Cu没有被全部置换出来,Cu2+ 没有完全反应掉,故残留固体全部为Cu;若Fe过量,且符合b<c,则残余固体可能为铁、铜混合物,所以B正确,D不正确;因为Fe3+能够氧化Cu,所以当残留固体中有Cu存在时,溶液中一定不含有Fe3+,所以A不正确。故选B。
点评:本题主要考查铁及其化合物的知识,要求会判断反应物与产物,题目难度中等。
本题难度:简单
5、简答题 工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝.工艺流程如下图: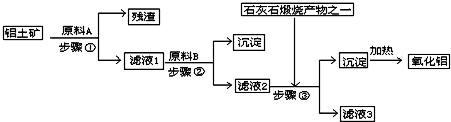
(1)原料A的名称是______,步骤①反应的离子方程式是______.
(2)滤液1中要加入稍过量原料B,原料B的化学式是______,步骤②反应的离子方程式是:______.
(3)步骤③的化学方程式是:______.
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响______.
参考答案:由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液②含有AlO2-.步骤②应加入氢氧化钠,所以滤液①中含有Al3+,步骤①应为加入盐酸,除去SiO2.
(1)由上述分析可知,步骤①加入盐酸,除去SiO2,所以原料A为盐酸,
氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O.
故答案为:Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O.
(2)步骤①加入过量盐酸,滤液①中含有Al3+、Fe3+、H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,反应为?H++OH-=H2O,Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O.
故答案为:NaOH;?H++OH-=H2O、Fe3++3OH-=Fe(OH)3、Al3++4OH-=AlO2-+2H2O.
(3)滤液②含有AlO2-,步骤③通入二氧化碳,与AlO2-反应生成的沉淀为氢氧化铝,
反应化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
(4)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质.
故答案为:若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质.
本题解析:
本题难度:一般