时间:2019-05-30 03:18:14
1、选择题 已知常温下,0.1mol/L的一元酸HA溶液的pH>1;0.1mol/L的一元碱MOH溶液中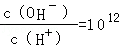 ,将此两种溶液等体积混合,混合夜中,离子浓度关系不正确的是( )
,将此两种溶液等体积混合,混合夜中,离子浓度关系不正确的是( )
A.c(OH
参考答案:
本题解析:
本题难度:困难
2、填空题 25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
A___________________________________________________;
B____________________________________________________;
C___________________________________________________。
(2)溶液中共有______________种不同的粒子。
(3)在这些粒子中,浓度为0.01mol/L的是 ;浓度为0.002mol/L的是 。
(4) 和 两种粒子物质的量之和等于0.01mol。
参考答案:H2O H++OH-、CH3COOH
H++OH-、CH3COOH CH3COO-+H+、CH3COO-+H2O
CH3COO-+H+、CH3COO-+H2O CH3COOH+OH-(各1分,顺序可以颠倒)
CH3COOH+OH-(各1分,顺序可以颠倒)
(2)7(1分) (3)Na+(1分)Cl-(1分) (4)CH3COOH、CH3COO-(2分,顺序可以颠倒)
本题解析:(1)醋酸是弱酸,盐酸是强酸,二者混合后反应生成醋酸和氯化钠,因此存在醋酸的电离平衡。又因为醋酸钠是过量的,所以还存在醋酸根离子的水解平衡。任何水溶液中都存在水的电离平衡,有关反应的方程式分别为H2O H++OH-、CH3COOH
H++OH-、CH3COOH CH3COO-+H+、CH3COO-+H2O
CH3COO-+H+、CH3COO-+H2O CH3COOH+OH-。
CH3COOH+OH-。
(2)根据以上方程式可知,溶液中含有水分子、醋酸分子、氢离子、氢氧根离子、醋酸根离子、氯离子、钠离子,共7种微粒。
(3)已知0.01molCH3COONa,则根据离子守恒可知,浓度为0.01mol?L-1的是Na+,由0.002molHCl可知,浓度为0.002mol?L-1的是Cl-。
(4)已知0.01molCH3COONa,则根据原子守恒可知CH3COOH、CH3COO-微粒之和为0.01mol。
考点:考查离子方程式的书写;物质的量浓度的相关计算;弱电解质在水溶液中的电离平衡
本题难度:一般
3、填空题 (1)下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样,并说明溶液的酸碱性:
K2CO3______,溶液呈______性;
K2SO4______,溶液呈______性;
NH4Cl______,溶液呈______性.
(2)物质的量浓度均为0.1mol/L的下列溶液:①KNO3、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH、⑦Ba(OH)2、⑧NH4Cl,pH由大到小的顺序为:______(填数字代号)
(3)现有常温下的0.1mol?L-1Na2CO3溶液:
①你认为该溶液呈碱性的原因是(用离子方程式表示)______;
②为证明你的上述观点,请设计一个简单的实验,简述实验过程______.
参考答案:(1)K2CO3是强碱弱酸盐,水解后水溶液都呈碱性,水解离子方程式为CO32-+H2O?HCO3-+OH-,
Na2SO4是强酸强碱盐,不水解,溶液呈中性;
NH4Cl是强酸弱碱盐,水解后溶液呈酸性,水解离子方程式为NH4++H2O?NH3?H2O+H+,
故答案为:CO32-+H2O?HCO3-+OH-;碱;不水解;中性;NH4++H2O?NH3?H2O+H+;酸;
(2)酸:⑤CH3COOH是弱电解质,所以只有部分电离,故c(H+)<0.1mol/L,所以pH>1;
碱:⑥NaOH是强电解质,完全电离,c(OH-)=0.1mol/L,所以pH=13;
⑦Ba(OH)2是强电解质,完全电离,c(OH-)=0.2mol/L,所以pH=13.7;
盐:④NaHSO4是强酸酸式盐,在水中完全电离成钠离子、硫酸根离子、氢离子,所以c(H+)=0.1mol/L,所以pH=1;
⑧NH4Cl是强酸弱碱盐,水解后溶液呈酸性,1<pH值<7;
①KNO3是强酸强碱盐,水溶液呈中性,pH=7;
②Na2CO3是强碱弱酸盐,水溶液都呈碱性;
③NaHCO3是弱酸的酸式盐水解显碱性,水解程度小于Na2CO3 ,碱性小于Na2CO3,所以pH由大到小的顺序为:⑦>⑥>②>③>①>⑧>⑤>④,
故答案为:⑦>⑥>②>③>①>⑧>⑤>④;
(3)①Na2CO3是强碱弱酸盐,水解后水溶液都呈碱性,其水解离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为;CO32-+H2O?HCO3-+OH-;
②向Na2CO3溶液中加酚酞试液,溶液变红色,说明溶液显碱性,证明Na2CO3水解,
故答案为:向Na2CO3溶液中加酚酞试液,溶液变红色,说明溶液显碱性,证明Na2CO3水解.
本题解析:
本题难度:一般
4、填空题 X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质。Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期。
(1)实验室用H2XO4制取XO2气体的化学反应方程式为 。(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1 mol·L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为 。
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式 。
(4)一定条件下,YO与YO2存在下列反应:YO(g)+ YO2(g)  Y2O3(g),其平衡常数表达式为K= 。
Y2O3(g),其平衡常数表达式为K= 。
(5)工业上用氧化YH3法制取YO,该反应的热化学方程式为:
4YH3(g)+5O2(g)=4YO(g)+6H2O(g) △H=-905.8kJ·mol-1;
已知Y2(g)+O2(g)=2YO(g) △H="+180" kJ·mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为 。
参考答案:
(1)Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
〔或2H2SO4(浓)+ Cu  CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
或2H2SO4(浓)+ S  3SO2↑+ 2H2O等合理答案〕(3分)
3SO2↑+ 2H2O等合理答案〕(3分)
(2)c(Na+)、c(HSO3-)、c(H+)、c(SO32-)、c(OH-)(2分)
(3)Al2O3+2OH-=2AlO2-+H2O(3分)
(4)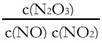 (2分)
(2分)
(5)4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1265.8kJ·mol-1(3分)
本题解析:与酸雨有关的两种氧化物为二氧化硫和氮的氧化物,X元素的原子序数大于Y,故XY分别为S和N,Z为Al。(1)实验室中一般用浓硫酸和Na2SO3反应或与铜反应制取二氧化硫;(2)NaHSO3溶液存在HSO3-的电离和水解平衡,根据溶液为酸性,确定以电离为主,故由大到小的顺序为c(Na+)、c(HSO3-)、c(H+)、c(SO32-)、c(OH-);(5)①-②×2得出对应热化学方程式4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1265.8kJ·mol-1
考点:考查物质结构、热化学方程式书写、离子浓度大小比较等有关问题。
本题难度:困难
5、填空题 (10分)氯化铁水解的离子方程式为  ______ ______ ___ ,
______ ______ ___ ,
配制氯化铁溶液时滴加少量盐酸的作用是 ___ ;
若向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐逐渐溶解,并产生无色气体,其离子方程式为 ,
同时有红褐色沉淀生成的原因是 、
把FeCl3溶液蒸干后再灼烧,最后得到的主要固体产物是
参考答案:
本题解析:略
本题难度:一般