时间:2019-05-30 03:17:52
1、填空题 (12分)近年来我国汽车拥有量呈较快增长趋势,NOx是汽车尾气中的主要污染物之一。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: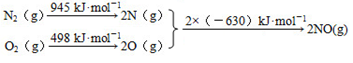
①写出该反应的热化学方程式 ,该反应的△S 0(填“>”、“<”或“=”);
②根据下图所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K 。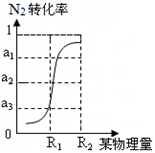
A.可能增大
B.一定不变
C.可能不变
D.可能减小
E.增大、减小、不变均有可能
(2)氮气是合成氨的原料之一,合成氨反应:N2(g)+3H2 (g) 2NH3(g) △H<0,500℃时将1molN2与1molH2充入容积为1L的密闭容器中发生反应,达到平衡后NH3的体积分数为20%。若升高温度至800℃,达到新的平衡时,H2的转化率 (填“增大”、“减小”或不变,下同),N2的体积分数 。
2NH3(g) △H<0,500℃时将1molN2与1molH2充入容积为1L的密闭容器中发生反应,达到平衡后NH3的体积分数为20%。若升高温度至800℃,达到新的平衡时,H2的转化率 (填“增大”、“减小”或不变,下同),N2的体积分数 。
(3)在汽车上安装高效催化转化器,将有毒气体转化为无毒气体,可有效降低NOx的排放。某研究性学习小组用气体传感器测得不同时间NO和CO的浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(×10-4mol·L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)(×10-3 mol·L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
2、选择题 下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)=C(金刚石)  可知,金刚石比石墨稳定
可知,金刚石比石墨稳定
C.一定条件下,将0.5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:
D.在稀溶液中, ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
3、选择题 已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ?mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1
下列说法正确的是( )
A.H2(g)的燃烧热为571.6kJ?mol-1
B.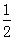 H2SO4(aq)+
H2SO4(aq)+ Ba(OH)2(aq)═
Ba(OH)2(aq)═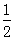 BaSO4(s)+H2O(l)△H=-57.3kJ?mol-1
BaSO4(s)+H2O(l)△H=-57.3kJ?mol-1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4kJ?mol-1
4、填空题 (8分) Q、W、X、Y、Z元素为前四周期元素,且原子序数依次增大,Q元素的阳离子核外无电子,W元素原子的最外层电子数是次外层电子数的2倍,Y是地壳中含量最多的元素,Z的价电子排布式为3d64s2。
(1)Z位于元素周期表第________周期第________族,
(2)W的第一电离能________(填“大于”或“小于”)X的第一电离能。
(3)Z基态原子的价电子排布图为______________________________________,Z的单质与过量的X 的最高价氧化物对应的水化物的稀溶液反应的离子方程式为____________________。
(4)已知:①WQ4(g)+4XY2(g)=4XY(g)+WY2(g)+2Q2Y(g) ΔH=-574 kJ/mol
②WQ4(g)+4XY(g)=2X2(g)+WY2(g)+2Q2Y(g) ΔH=-1 160 kJ/mol
此温度下若用4.48 L(已折算成标准状况下)WQ4还原XY2至X2。整个过程中放出的热量为___kJ。
5、填空题 (10分)甲醇合成反应为:CO(g)+2H2(g)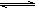 CH3OH(g)
CH3OH(g)
(1)合成甲醇的反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式 。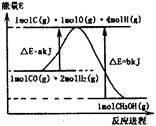
(2)实验室在lL密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol?L—l)
| 温度\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
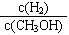 减小
减小