时间:2019-05-30 03:17:04
1、选择题 石榴石是石榴石族矿物的总称,颜色随成分的不同而变化,其组成可以表示为A3B2(SiO4)3,式中A、B均 为金属元素,则A、B对应的化合价依次为
[? ]
A.+2,+3
B.+3,+2
C.+2,+2
D.+3,+3
参考答案:A
本题解析:
本题难度:简单
2、简答题 如图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍.(用元素符号表示)
(1)A______B______C______.
(2)B的最高价氧化物的化学式______,属于______晶体.
(3)C的气态氢化物的化学式______,其中存在______键.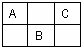
参考答案:设B的原子序数为x,根据三种元素所在元素周期表中的位置可知,A的原子序数为x-9,C的原子序数为x-7,
原子核外电子数=质子数=原子序数,则有x-7+x-9+x=2x,x=16,所以B为S元素,A为N元素,C为F元素,
(1)由以上分析可知,B为S元素,A为N元素,C为F元素,故答案为:N;S;F;
(2)B为S元素,S元素最外层电子数为6,则最高正化合价为+6价,则最高价氧化物的化学式为SO3,属于分子晶体,
故答案为:SO3;分子;
(3)C为F元素,C的气态氢化物的化学式为HF,由非金属元素形式的化合物,原子间的作用力为共价键,
故答案为:HF;共价.
本题解析:
本题难度:一般
3、选择题 金属铜可与盐酸、氧气发生反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列有关HO2的说法正确的是
[? ]
A.具有较强的氧化性
B.在碱中能稳定存在
C.氧元素的化合价均为-1价
D.结构式为O-H-O
参考答案:A
本题解析:
本题难度:一般
4、简答题 图为周期表中短周期的一部分.已知a原子的最外层上的电子数目是次外层电子数目的一半,下列说法中不正确的是( )
A.元素a的最高价氧化物的水化物的酸性比b弱
B.元素a的原子半径比d的大
C.元素a的单质在空气中燃烧会导致“温室效应”
D.元素a单质是一种良好的半导体材料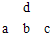
参考答案:元素为短周期元素,根据a元素的原子结构特点和四种元素在周期表中的相对位置可知a为Si元素,b为P元素,d为N元素,c为S元素,则
A.同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性增强,则元素a的最高价氧化物的水化物的酸性比b弱,故A正确;
B.根据a、d在周期表中的位置可知,a比d原子核外多一个电子层,核外电子层数越多,原子半径越大,故B正确;
C.a为Si元素,与氧气的反应产物为二氧化硅,不是导致温室效应的物质,故C错误;
D.a为Si元素,是一种良好的半导体材料,故D正确.
故选C.
本题解析:
本题难度:一般
5、填空题 请回答下列问题:
(1)下列现象和应用与电子跃迁无关的是________________________________。
A.激光? B.焰色反应 C.原子光谱? D.燃烧放热? E.石墨导电
(2)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有_______个σ键。
(3)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有___________(填元素符号)?
②在a:苯? b:CH3OH? c:HCHO? d:CS2? e:CCl4 五种有机溶剂中,碳原子采取sp3杂化的分子有___________(填字母),CS2分子的键角是__________。
③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O) 6]2+显粉红色。据此判断,[Mn(H2O) 6]]2+? _____________(填“无”或“有”)颜色
(4) 请写出HClO的电子式:_______________________;在下图配合物离子[Cu(NH3)4]2+.中的画出配位键: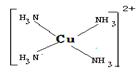
(5) A、B均为短周期金属元素。依据下表数据和已学知识,
| 电离能/KJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
参考答案:(1)D?、 E?(2分,漏选得1分,有错选不得分)
(2)? 12?(1分)
(3)? ① Cu? K?(2分,写对一个给1分,全部写对得满分)
② b? e (2分,漏选得1分,有错选不得分) 1800?(1分)
③?有?(1分)
(4) 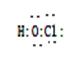 ?
?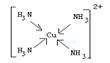 (各1分)、
(各1分)、
(5)? 3s2(1分) 2Mg+CO2 ="==" 2MgO+C (2分)
本题解析:(1)燃烧放热、石墨导电都与电子跃迁无关,故本题的答案选择DE;(2)A、B两种短周期元素,A是原子半径最小的元素,故A为H元素;B原子最外层电子数是次外层的两倍,所以B为C;某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子苯,所以其中含有12个σ键;(3)①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有Cu 、K;②在a:苯? b:CH3OH? c:HCHO? d:CS2? e:CCl4 五种有机溶剂中,碳原子采取sp3杂化的分子b和e,而a和c中碳原子是采用sp2杂化,d中碳原子采用的是sp杂化,其分子结构为直线型,故CS2分子的键角是1800;③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O) 6]2+显粉红色,其中Co为d7,[Mn(H2O) 6]]2+中Mn为d5,所以其有颜色;(4) 请写出HClO的电子式为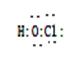 ;配合物离子[Cu(NH3)4]2+.中的配位键如下:
;配合物离子[Cu(NH3)4]2+.中的配位键如下: 注意的是铜离子提供空轨道,而氨气中的N原子提供孤独电子;(5) 从表可以推断出A、B分别为Na、Mg,所以B的价电子电子排布式为:3s2,镁与二氧化碳的反应的方程式为:2Mg+CO2 ="==" 2MgO+C。
注意的是铜离子提供空轨道,而氨气中的N原子提供孤独电子;(5) 从表可以推断出A、B分别为Na、Mg,所以B的价电子电子排布式为:3s2,镁与二氧化碳的反应的方程式为:2Mg+CO2 ="==" 2MgO+C。
点评:本题考查了电子跃迁、杂化类型、电子式、配位键、电离能,该题综合性强,难度中等。
本题难度:一般