时间:2019-05-30 03:15:41
1、填空题 ( 10分)有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。?请回答:
(1)Y的最高价氧化物对应水化物的化学式是____________
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是________________________,此液体具有的性质是__________________(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”?
b.插入电极通直流电后,有一极附近液体颜色加深?
c.向该液体中加入硝酸银溶液,无沉淀产生?
d.将该液体加热、蒸干、灼烧后,有氧化物生成?
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。?
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为_________________________
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)溶液在一定条件下反应,可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是____________________________
参考答案:(1)HClO4?(2)Fe3++3H2O Fe(OH)3(胶体)+3H+?a、b、d
Fe(OH)3(胶体)+3H+?a、b、d
(3)①90%? ②SO2+2HClO3===H2SO4+2ClO2
本题解析:(1)ZY3溶液遇苯酚呈紫色,说明Z是Fe,Y是Cl。X2-、Y-均与Y的气态氢化物分子具有相同的电子数,所以X是S。氯元素的最高价是+7价,所以Y的最高价氧化物对应水化物的化学式是HClO4。
(2)将氯化铁溶液滴入沸水可得到红褐色液体,这是实验室制备氢氧化铁胶体的,因此该分散系属于胶体,反应的离子方程式是Fe3++3H2O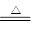 Fe(OH)3(胶体)+3H+。胶体具有丁达尔效应,能发生电泳选项,与能发生聚沉,且生成的氢氧化铁固体受热可以分解生成氧化铁和水,所以选项a、b、d都是正确的,c不正确,答案选abd。
Fe(OH)3(胶体)+3H+。胶体具有丁达尔效应,能发生电泳选项,与能发生聚沉,且生成的氢氧化铁固体受热可以分解生成氧化铁和水,所以选项a、b、d都是正确的,c不正确,答案选abd。
(3)①根据反应热可知,参加反应的SO2的物质的量是176.4 kJ÷98.0 kJ/mol=1.8mol,所以SO2的转化率是1.8mol÷2mol=90%。
②该酸的某盐常用于实验室制取氧气,所以该盐是氯酸钾。转移电子的物质的量是1.5mol,这说明在反应中氯酸钾得到1个电子,因此氯酸钾的还原产物中氯元素的化合价是+4价,则应该是ClO2,所以该反应的化学方程式是SO2+2HClO3===H2SO4+2ClO2。
点评:该题属于中等浓度的试题,主要考查学生对常见基础知识的掌握程度,以及灵活运用知识解决实际问题的能力。关于对热化学方程式和焓变的理解、计算,以及氧化还原反应的有关计算并不麻烦。化学计算的实质是用数学工具处理化学问题,不仅能考查学生利用化学知识解决化学问题能力,而且还能考查学生的形象思维能力。
本题难度:一般
2、选择题 如图为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
A.非金属性:Y>Z>M
B.X为稀有气体元素
C.原子半径:M>Z>Y
D.Y原子的结构示意图可表示为: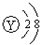
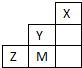
参考答案:由元素在周期表中的相对位置可知,X为氦元素,Y为F元素,Z为S元素,M为Cl元素.
A、同周期随原子序数增大,非金属性增强,所以非金属性M>Z,同主族自上而下非金属性减弱,所以非金属性Y>M,所以非金属性Y>M>Z,故A错误;
B、X为氦元素,属于稀有气体元素,故B正确;
C、同周期随核电荷数增大,原子半径减小,所以原子半径Z>M,同主族自上而下原子半径增大,所以原子半径M>Y,所以原子半径Z>M>Y,故C错误;
D、氟原子质子数为9,核外电子数为9,有2个电子层,最外层有7个电子,原子结构示意图为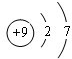
,故D错误.
故选:B.
本题解析:
本题难度:简单
3、选择题 化学无处不在,下列与化学有关的说法,不正确的是(?)
A.侯氏制碱法的工艺过程中应用了物质溶解度的差异
B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
C.碘是人体必须微量元素,所以要多吃富含高碘酸的食物
D.黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成
参考答案:C
本题解析:A、侯氏制碱法是将CO2、NH3通入饱和NaCl溶液中,由于NaHCO3溶解度小于Na2CO3,故NaHCO3在溶液中析出,正确; B、浓盐酸易挥发,与NH3结合生成NH4Cl固体小颗粒,冒白烟,正确; C、碘是人体必需元素,补碘常在食盐中加入KIO3固体而不是高碘酸,高碘酸为强酸性物质,错误; D、制备黑火药的原料为S、KNO3、C,三者比例为1:2:3 ,正确。
本题难度:一般
4、选择题 下列说法正确的是
[? ]
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由ⅠA族和ⅥA族元素形成的原子个数比为1︰1、电子总数为38的化合物,是含有共价键的离子型化合物
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列物质性质变化规律正确的是
[? ]
A.金属Na、Mg、Al的硬度依次降低
B.HI、HBr、HCl、HF的沸点依次降低
C.干冰、钠、冰的熔点依次降低
D.O、F、H的原子半径依次减小
参考答案:D
本题解析:
本题难度:一般