时间:2019-05-30 03:02:00
1、选择题 将14g铜银合金与足量的一定浓度的硝酸溶液反应,把放出的气体与标准状况下体积为1.12L的O2混合后再通入水中,恰好全部被吸收,则合金中铜的质量为
A.3.2g
B.4.8g
C.6.4g
D.10.8g
参考答案:A
本题解析:反应中合金失电子,氧气得电子,硝酸最终仍然是硝酸,可认为没有电子的得失
设铜银的物质的量分别为x、y,则64x+108y=14
由电子的得失守恒得:2x+y=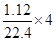
解得:x=0.05mol? y=0.1mol
铅的质量为3.2g
本题难度:一般
2、选择题 向Fe和Fe2O3的混合物中加入足量的稀硫酸,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为5︰2时,则Fe和Fe2O3的物质的量之比为
A.3︰1
B.1︰2
C.2︰1
D.1∶1
参考答案:A
本题解析:假设n(H2)=2mol,则由反应:Fe+ H2SO4= FeSO4+H2↑。消耗的Fe为2mol,产生的Fe2+的物质的量为2mol.由方程式Fe2O3+3H2SO4=2Fe2(SO4)3+3H2O和Fe+2Fe2(SO4)3=3FeSO4.可得关系式Fe——Fe2O3—3Fe2+. Fe2+是3mol,所以n(Fe)=1mol,n(Fe2O3)=1mol.因此原固体中Fe和Fe2O3的物质的量之比为3:1.选项为A.2O3的混合物与硫酸反应的知识。
本题难度:一般
3、实验题 (15分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。?应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
(1)写出该反应的反应方程式? ?;
?; 并指明该氧化还原反应的还原剂是?,氧化剂是?。
并指明该氧化还原反应的还原剂是?,氧化剂是?。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是??;烧瓶底部放置了几片碎瓷片,其作用是? ?。
(3)试管中收集气体是?,如果要在A处玻璃管处点燃该气体,则必须对该气体进行?。
参考答案:.(15分)
(1)? 3Fe+ 4H2O(气)= 高温= Fe3O4+ 4 H23分,以下空各2分?Fe???H2O
本题解析:略
本题难度:一般
4、填空题 下列物质之间有如下反应关系:
已知由E转化成C的现象是:白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
(1)写出下列物质的化学式:甲________,丙________。
(2)写出E→C反应的化学方程式:___________________________。为了获得E,可以用新配制的D溶液与用不含O2的蒸馏水配制的乙溶液反应制备。
(3)用相应晶体配制上述D溶液时你觉得还需加入?。
(4)写出Fe与H20在一定条件下反应的化学方程式? 。
参考答案:(1) Cl2 KSCN?(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)铁粉?(4)3Fe + 4H20(g) Fe3O4+4H2
Fe3O4+4H2
本题解析:(1)A为红棕色粉末,则A为Fe2O3,A与盐酸反应生成B,B为FeCl3,D为FeCl2,乙为NaOH,则E为Fe(OH)2,C为Fe(OH)3,由D→B的转化可知,甲为氯气或氯水等,由血红色溶液可知,丙为KSCN;(2)E→C反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;(3)用相应晶体配制FeCl2溶液时需加入铁粉;(4)Fe与H20在一定条件下反应的化学方程式为:3Fe+4H20(g) Fe3O4 +4H2 ?。
Fe3O4 +4H2 ?。
本题难度:一般
5、实验题 某课外活动小组设计了如下图所示的实验装置进行实验。回答下列问题: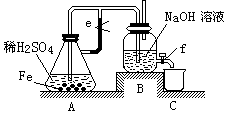
⑴ 开始实验时弹簧夹e是打开的,A中发生反应的离子方程式为:?,
B中可以观察到的现象是??。
⑵ 数分钟后夹上弹簧夹e,B中可以观察到的现象是?。
⑶ 如果开启活塞f放掉2/3液体,B中可观察到的现象是?,
有关反应的化学方程式是?。
参考答案:(1) Fe+2H+==Fe2++H2↑;有气泡冒出?(2)有白色沉淀生成
(3)白色沉淀先变成灰绿色,最后变成红褐色沉淀; 4Fe(OH)2+O2+2H2O==4Fe(OH)3
本题解析:(1)铁和稀硫酸反应生成氢气和硫酸亚铁,反应的离子方程式是Fe+2H+==Fe2++H2↑,氢气不溶于水,所以B中可以观察到的现象是有气泡冒出。
(2)由于A中的反应并没有停止,而生成的氢气的又难溶于水,所以随着反应的进行,A中的压强增大,将溶液压入B中,从而生成氢氧化亚铁白色沉淀。
(3)如果开启活塞f放掉2/3液体,则空气将进入B中。而氢氧化亚铁又极易被氧化,所以实验现象是白色沉淀先变成灰绿色,最后变成红褐色沉淀,反应的化学方程式是 4Fe(OH)2+O2+2H2O==4Fe(OH)3。
点评:氢氧化亚铁由于极易被氧化,所以该题的实验原理是利用生成的氢气将装置中的空气派出,从而可以很明显的看到白色的氢氧化亚铁的生成,且颜色能保持较长的时间。
本题难度:一般