时间:2019-05-30 02:59:49
1、选择题 实验结束后,下列仪器的位置放置方法正确的是
A.
B.
C.
D.
2、选择题 已知溶液中C(Na+)=0.2mol/L,C(Mg2+)=0.25mol/L,C(Cl-)=0.4mol/L,如果溶液中还有SO42-,那么C(SO42-)应为
A.0.1mol/L
B.0.3mol/L
C.0.15mol/L
D.0.5mol/L
3、选择题 化学反应经常伴随着颜色变化,下列有关反应的颜色变化不正确的是
A.苯酚遇FeCl3溶液——紫色
B.溴化银见光分解——白色
C.新制氯水久置后——无色
D.苯酚在空气中氧化——粉红色
4、填空题 工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为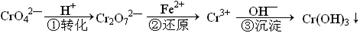
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。(选填编号)
A.Cr2O72—和CrO42—的浓度相同
B.v正(Cr2O72—) ="2v" 逆(CrO42—)
C.溶液的颜色不变
D.溶液的pH值不变
(3)写出第②步中Cr2O72-转变为Cr3+的离子方程式: 。
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]-离子。其平衡关系如下: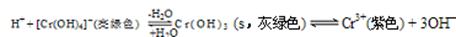
现向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象为 ,溶液中离子浓度由大到小的顺序为 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以 形式存在(填写离子符号)。
5、选择题 对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.0.1mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.将0.2mol·L-1NaA溶液和0.1mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25℃时,1mol/L的Na2S溶液中:c(OH-)= c(H+)+c(HS-)+2c(H2S)