时间:2019-05-30 02:48:53
1、填空题 (1)25℃时,pH=12.0的KOH溶液中,由水电离出的C(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的C(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因:
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外)
(3)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): , 实验室在配制FeCl3的溶液时,常将FeCl 3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解,否则得到的是浑浊的溶液。
参考答案:(1)1×10-12 1×10-2
(2)CH3COO-+H2O CH3COOH+OH- c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
CH3COOH+OH- c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(3)酸性 Fe3++3H2O  Fe(OH)3+3H+ HCl 抑制
Fe(OH)3+3H+ HCl 抑制
本题解析:(1)抑制水电离,含有弱根离子的盐促进水电离,碱溶液中水电离出的c(OH-)=c(H+)=10-12 mol/L,K2CO3是强碱弱酸盐,促进水电离,溶液中水电离出的c(OH-) 为水的离子积常数与c(H+)的比,所以水电离出来的c(OH-)=10?14/10?12mol/L=10-2 mol/L。(2)①醋酸钠中醋酸根离子能水解,导致溶液显示碱性,即CH3COO-+H2O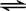 CH3COOH+OH- ,②按物质的量浓度由大到小顺序排列该溶液中各种微粒为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-);(3)FeCl3的水溶液中,由于三价铁离子的水解,导致溶液呈酸性,Fe3++3H2O
CH3COOH+OH- ,②按物质的量浓度由大到小顺序排列该溶液中各种微粒为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-);(3)FeCl3的水溶液中,由于三价铁离子的水解,导致溶液呈酸性,Fe3++3H2O  Fe(OH)3+3H+ ,将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,这样盐酸可以抑制三价铁离子水解;
Fe(OH)3+3H+ ,将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,这样盐酸可以抑制三价铁离子水解;
考点:离子积常数;溶液pH的定义;铁的化学性质。
本题难度:困难
2、选择题 下列溶液中有关物质的量浓度关系不正确的
A.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A)
参考答案:B
本题解析:A项是电荷守恒,正确;NaOH是强碱,完全电离,CH3COONa和Na2CO3溶液是因为水解溶液显碱性,CO32-的水解程度比CH3COO-大,要pH相同,CH3COONa更大才行,B不正确;由电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+)和物料守恒c(CH3COO-)+c(CH3COOH)=2c(HNa+)可得c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),C正确;NaHA溶液的pH=4说明HA-的电离程度比水解程度大,D正确。
考点:溶液中的守恒规律的应用、电离和水解程度对溶液的酸碱性的影响。
本题难度:困难
3、选择题 下列说法正确的是:
A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.在0.1mol/LNa2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32
参考答案:
本题解析:
本题难度:一般
4、选择题 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg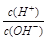 ,室温下实验室用0.01 mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如右图所示。下列有关叙述正确的是( )
,室温下实验室用0.01 mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如右图所示。下列有关叙述正确的是( )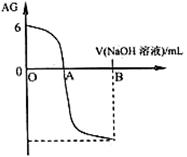
A.A点时加入氢氧化钠溶液体积为20 mL
B.室温时0.01 mol·L-1的醋酸溶液pH=4
C.OA段溶液中:c(CH3COO-)> c(CH3COOH)
D.若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH) = c(OH-) - c(H+)
参考答案:BD
本题解析:A.A点时AG=0,则c(H+)=c(OH-).溶液显中性,由于醋酸是弱酸,二者的浓度相等,所以加入氢氧化钠溶液体积为20 mL,恰好中和,则吃剩的盐水解是溶液显碱性,所以A点时加入氢氧化钠溶液体积小于20 mL,错误;B.在开始时溶液的AG=6,c(H+)/c(OH-)=106;c(H+)·c(OH-)=10-14;则c(H+)=10-4,所以在室温时0.01 mol·L-1的醋酸溶液pH=4,正确;C.由于在A点时溶液显中性,在A之前,溶液呈酸性,在A之后溶液显碱性,所以OA段溶液中是CH3COOH和CH3COONa的混合溶液,由于酸的电离作用大于盐的水解作用,所以c(H+)>c(OH-),但是不能比较c(CH3COO-)和 c(CH3COOH)大小,因此不能确定c(CH3COO-)> c(CH3COOH),错误;D.若B点时加入NaOH溶液40 mL,则所得溶液是CH3COOH和CH3COONa的等物质的量的混合溶液。根据物料守恒可得c(Na+)="2" c(CH3COO-)+2 c(CH3COOH);根据电荷守恒可得:c(H+)+ c(Na+)=c(CH3COO-)+ c(OH-) ,第二个式子减去第一个式子,整理可得:c(CH3COO-)+2 c(CH3COOH) = c(OH-) - c(H+),正确。
考点:考查溶液的酸碱性和离子浓度的大小比较的知识。
本题难度:一般
5、选择题 某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变
④c(H+)·c(OH)-的积不变⑤c(H+)一定增大
A.①
B.①⑤
C.①②④
D.①③
参考答案:B
本题解析:氧化钙能和水反应生成氢氧化钙,同时放热。由于氢氧化钙是饱和溶液,且氢氧化钙的溶解度随温度的升高而降低,所以溶液中会析出晶体。溶解度降低,浓度减小,因此碱性降低,所以氢离子浓度增大答案选B。
本题难度:一般