时间:2019-05-30 02:41:59
1、填空题 (1)已知红磷比白磷稳定,又知:4P(白磷,s)+5O2(g)=2P2O5(s) △H1;
4P(红磷,s)+5O2(g)=2P2O5(s) △H2,则ΔH1和ΔH2的关系是△H1 △H2(填“>”、“<”
或“=”)。
(2)已知H2(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1和-726.5kJ·mol-1,写出由CO2
和H2生成液态甲醇和液态水的热化学方程式 。
(3)已知一定温度下,下列反应的平衡常数:SO2(g)+1/2O2(g)  SO3(g) K1,CO(g)+1/2O2(g)
SO3(g) K1,CO(g)+1/2O2(g)  CO2(g) K2。则相同温度下反应SO2(g)+CO2(g)
CO2(g) K2。则相同温度下反应SO2(g)+CO2(g)  SO3(g)+CO(g)的平衡常数为 。
SO3(g)+CO(g)的平衡常数为 。
(用K1、K2表示)
参考答案:(共6分)< (2)3H2(g)+CO2(g)=CH3OH(l+H2O(l) △H=-130.9 kJ/mol (3)
本题解析:(1)红磷比白磷稳定,这说明红磷的总能量低于白磷的总能量,即红磷转化为白磷是吸热反应,△H>0。根据反应①4P(白磷,s)+5O2(g)=2P2O5(s) △H1和②4P(红磷,s)+5O2(g)=2P2O5(s) △H2,依据盖斯定律可知,②-①即得到反应4P(红磷,s)=4P(白磷,s),则该反应的△H=△H2-△H1>0,所以△H1<△H2。
(2)H2(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1和-726.5kJ·mol-1,则有反应①H2(g)+ O2(g)=H2O(l) △H=-285.8kJ/mol、②CH3OH(l)+
O2(g)=H2O(l) △H=-285.8kJ/mol、②CH3OH(l)+ O2(g)=2H2O(l)+CO2(g) △H=-726.5kJ/mol。则根据盖斯定律可知,①×3-②即得到反应3H2(g)+CO2(g)=CH3OH(l+H2O(l),因此该反应的反应热△H=-285.8kJ/mol×3+726.5kJ/mol=-130.9 kJ/mol。
O2(g)=2H2O(l)+CO2(g) △H=-726.5kJ/mol。则根据盖斯定律可知,①×3-②即得到反应3H2(g)+CO2(g)=CH3OH(l+H2O(l),因此该反应的反应热△H=-285.8kJ/mol×3+726.5kJ/mol=-130.9 kJ/mol。
(3)根据反应①SO2(g)+1/2O2(g)  SO3(g)、②CO(g)+1/2O2(g)
SO3(g)、②CO(g)+1/2O2(g) CO2(g)可知,①-②即得到反应SO2(g)+CO2(g)
CO2(g)可知,①-②即得到反应SO2(g)+CO2(g)  SO3(g)+CO(g),所以则相同温度下反应SO2(g)+CO2(g)
SO3(g)+CO(g),所以则相同温度下反应SO2(g)+CO2(g)  SO3(g)+CO(g)平衡常数K=
SO3(g)+CO(g)平衡常数K= 。
。
考点:考查反应热的计算、热化学方程式的书写以及平衡常数的计算等
本题难度:一般
2、填空题 由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
。
已知H2O(l) = H2O (g) ΔH = +44 kJ·mol-1,则标准状况下33.6 L H2生成液态水时放出的热量是 kJ 。
参考答案:(1)H2(g)+1/2O2(g)===H2O(g);ΔH=-241.8 kJ/mol (2)428.25kJ
本题解析:氢气和氧气反应生成1 mol水蒸气放热241.8kJ,所以该反应的热化学方程式是H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol。已知H2O(l) = H2O (g) ΔH = +44 kJ/mol,则根据盖斯定律可知,H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol。标准状况下33.6 L H2的物质的量是1.5mol,所以生成液态水时放出的热量是285.8 kJ/mol×1.5mol=428.25kJ。
考点:考查反应热的计算和热化学方程式的书写
点评:该题是基础性试题的考查,侧重对学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑思维能力和规范的答题能力,难度不大。
本题难度:一般
3、选择题 下列中和反应热化学方程式可用:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1来表示的是( ? )
A.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1?kJ?mol-1
B.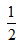 H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H=-Q2?kJ?mol-1
H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H=-Q2?kJ?mol-1
C.HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l);△H=-Q3?kJ?mol-1
D.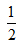 H2SO4?(aq)+
H2SO4?(aq)+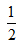 Ba(OH)2(aq)=
Ba(OH)2(aq)=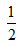 BaSO4?(s)+H2O(l);△H=-Q4?kJ?mol-1
BaSO4?(s)+H2O(l);△H=-Q4?kJ?mol-1
参考答案:C
本题解析:
本题难度:一般
4、选择题 已知胆矾溶于水时,溶液温度降低。在室温下将1mol无水硫酸铜制成溶液时,放出热量为Q1kJ,而胆矾分解的热化学方程式是CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q2kJ/mol,则Q1与Q2的关系是
[? ]
A.Q1>Q2
B.Q1=Q2
C.Q1<Q2
D.无法确定
参考答案:C
本题解析:
本题难度:一般
5、简答题 四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性.该过程中有如下反应发生.
2Fe3++Fe═3Fe2+
2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
加入铁屑的作用是______.
(2)在②→③工艺中需要控制条件以形成TiO2?nH2O溶胶,该分散质颗粒直径大小在______范围.
(3)若把③中制得的固体TiO2?nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉.已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+?Fe3++H2O的平衡常数K=______.
(4)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1;2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:______.
(5)上述工艺具有成本低、可用低品位矿物为原料等优点.依据绿色化学理念,该工艺流程中存在的不足之处是______(只要求写出一项).
(6)依据如表信息,要精制含少量SiCl4杂质的TiCl4,可采用______方法.
| TiCl4 | SiCl4 熔点/℃ -25.0 -68.8 沸点/℃ 136.4 57.6 参考答案:(1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有Ti3+,由方程式可知,Fe3+氧化为Ti3+,加入铁屑作还原剂,将Fe3+还原为Fe2+,防止Ti3+被Fe3+氧化成TiO2+, 本题解析: 本题难度:一般 |