时间:2019-03-14 23:08:07
1、选择题 某同学对铁的氧化物产生浓厚兴趣,查阅资料后制成以下卡片:
在空气中把铁灼烧至5000C就形成Fe3O4;温度再升高,可形成Fe2O3,在更高的温度下加热Fe2O3(约14000C)时,可失去氧,又得到Fe3O4。即: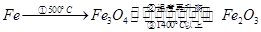 |
参考答案:B
本题解析:A 错误,Fe2O3是红棕色固体
B 正确,反应②③铁元素都有化合价的变化,所以,都是氧化还原反应。
C 错误,热稳定性顺序为:FeO>Fe3O4>Fe2O3
D 错误,四氧化三铁中铁元素的化合价复杂,若视四氧化三铁为一种盐,则其化学式可写为Fe(FeO2) 2
本题难度:一般
2、选择题 工业上常用铁屑跟硫酸反应并经除杂、浓缩、结晶、干燥等过程,来制取绿矾晶体(FeSO4·7H2O),已知浓硫酸能够氧化Fe2+,为了得到较纯的绿矾晶体,合理的方法是
A.使用硫酸过量
B.使用铁屑过量
C.使用稀硫酸
D.使用浓硫酸
参考答案:BC
本题解析:略
本题难度:一般
3、填空题 (8分)Fe跟Cl2在一定条件下反应,所得产物的化学式是?。将该产物溶于水配成溶液,分装在两支试管中。请回答:
(1)若向其中一支试管中滴加KSCN溶液,则溶液变成?色。
(2)向另一支试管中滴加NaOH溶液,现象为?,产物的化学式是______________。
参考答案:FeCl3?红?产生红褐色沉淀? Fe(OH)3
本题解析:略
本题难度:一般
4、简答题 Fe是地壳中含量很丰富的元素,也是生物体所必需的元素.自然界中的铁矿石主要有赤铁矿和磁铁矿,金属铁是在高炉中冶炼的,高炉炼铁除了加入铁矿石外,还需加入焦炭和石灰石.请填空:
①写出磁铁矿主要成分的化学式:______.
②写出赤铁矿被还原成铁的化学方程式:______.
③写出CaCO3所参与反应的两个化学方程式:______,______.
参考答案:①磁铁矿的主要成分为Fe3O4,故答案为:Fe3O4;
②因一氧化碳能与氧化铁反应生成铁和二氧化碳,反应的方程式为Fe2O3+3CO高温.2Fe+3CO2,
故答案为:Fe2O3+3CO高温.2Fe+3CO2
③石灰石的作用是形成炉渣,CaCO3所参与反应的两个化学方程式为:CaCO3高温.CaO+CO2↑;CaO+SiO2高温.CaSiO3
故答案为:CaCO3高温.CaO+CO2↑;CaO+SiO2高温.CaSiO3
本题解析:
本题难度:一般
5、实验题 为测定 FeO 和 Fe2O3 固体混合物中 Fe元素的含量,可用氢气还原一定质量的此混合物并测定生成水的质量的方法来完成。若在实验室中选用下列实验装置来实现上述目的(图中夹持装置已略去,部分装置可重复使用)。请填空: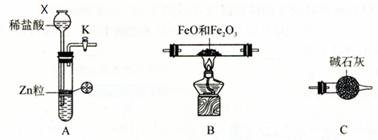
⑴仪器X的名称是?。
⑵写出A中发生反应的离子方程式?,
实验前如何检验装置A的气密性?。
⑶下图所示装置中与A装置具有相同作用的是?(填装置编号)。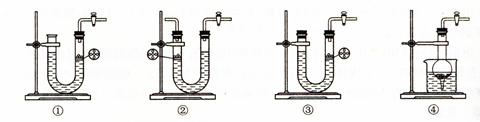
⑷按正确的实验设计,所连接的装置顺序为:A→C→?→?→?。
⑸若FeO和Fe2O3混合物的质量为 ag,反应完全后生成水的质量为 b g,则混合物中Fe元素的质量分数为?(用含字母的数学式表示)。
参考答案:(12分)⑴长颈漏斗。⑵Zn +2H+ = Zn2+ + H2↑,?
关闭活塞K,向长颈漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气。
⑶①④?⑷B→C→C。?⑸(1-8b/9a)×100%(或1-8b/9a)(其他合理答案也可。)
本题解析:(1)根据X的结构可知,X是长颈漏斗。
(2)A装置是制取氢气的,所以方程式为Zn +2H+ = Zn2+ + H2↑。由于A装置中是长颈漏斗,所以检验气密性的正确方法是关闭活塞K,向长颈漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气。
(3)A装置是简易启普发生器,当关闭K后,产生的气体使固体和液体分离,从而反应停止。所以选项①④正确。
(4)由于生成的氢气中会混有氯化氢和水蒸气,所以应该先除杂和干燥。由于要测量反应中生成的水蒸气,且还要防止空气中的水蒸气进入,因此正确的连接顺序是A→C→B→C→C。
(5)bg水中氧元素的质量是8b/9,所以混合物中铁元素的质量是(a-8b/9)g,因此铁元素的质量分数是(1-8b/9a)×100%(或1-8b/9a)。
本题难度:一般