时间:2019-03-14 23:03:40
1、选择题 据报道,某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式为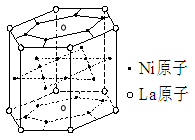
A.LaNi6
B.LaNi3
C.LaNi4
D.LaNi5
参考答案:D
本题解析:正确答案:D,La为12×1/6+2×1/2=3;Ni为18×1/2+6=15,所以化学式为LaNi5,选D。
本题难度:一般
2、选择题 下列各项中,理由、结论及因果关系均正确的是
| 选项 | 理由 | 结论 |
| A | 键能:N≡N>Cl-Cl | 单质沸点:N2>Cl2 |
| B | 分子中可电离的H+个数:H2SO4>CH3COOH | 酸性:H2SO4>CH3COOH |
| C | 元素的非金属性:N>P | 酸性:HNO3>H3PO4 |
| D | 氧化性:Fe3+>Cu2+ | 还原性:Fe2+>Cu |
参考答案:C
本题解析:分子晶体的键能决定了它们的稳定性,而分子间作用力决定其溶沸点,错误;B、酸性的强弱与酸电离出H+的难易程度有关,与每个分子电离出H+个数无关,错误;C、元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,正确;D、一般来说微粒的氧化性越强,其对应的得电子后的还原性微粒还原性就越弱,故Fe2+<Cu,错误。
本题难度:简单
3、选择题 下列对物质性质的描述中属于分子晶体的是
A.熔点是97.80℃,质软、导电,密度是0.97g/cm3
B.常温常压下是液体,溶于水后能导电
C.熔点极高,硬度极大,液态、固态时,均不能导电
D.固态不能导电,熔点较高,但在熔融状态可以导电
参考答案:B
本题解析:
正确答案:B
A、分子晶体不导电;B、正确;C、不正确,是原子晶体的特点;D、不正确,是离子晶体的特点。
本题难度:一般
4、选择题 下列关于晶体与非晶体之间的区别的叙错误的是
[? ]
A.化学性质不同
B.物理性质不同
C.外观形状不同
D.微粒状态不同
参考答案:D
本题解析:
本题难度:简单
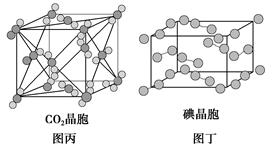
5、选择题 有关晶体的结构如图所示,下列说法中不正确的是( )。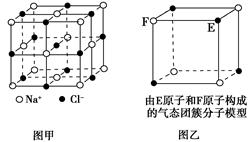
A.在NaCl晶体(图甲)中,距Na+最近的Cl-形成正八面体
B.该气态团簇分子(图乙)的分子式为EF或FE
C.在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D.在碘晶体(图丁)中,碘分子的排列有两种不同的方向
参考答案:B
本题解析:B中,由于是气态团簇分子,其分子式应为E4F4或F4E4。
本题难度:简单