时间:2019-03-14 23:02:16
1、选择题 下列元素中,属于第ⅦA族的是( )
A.锂
B.氯
C.钠
D.氮
参考答案:主族的划分依据是最外层电子数,最外层电子数为7的元素属于第ⅦA族,氯的原子结构示意图为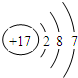 ,所以氯属于第ⅦA族,而AC为第ⅠA族元素,D为第ⅤA族,
,所以氯属于第ⅦA族,而AC为第ⅠA族元素,D为第ⅤA族,
故选:B.
本题解析:
本题难度:一般
2、选择题 下列有关比较中,大小顺序排列正确的是
[? ]
A.热稳定性:PH3> H2S> HBr> NH3
B.离子半径:Ca2+>K+>Cl->S2-
C.物质沸点:碘化氢>溴化氢>氯化氢>氟化氢
D.物质酸性:盐酸>乙酸>碳酸>苯酚
参考答案:D
本题解析:
本题难度:一般
3、选择题 元素性质呈周期性变化的决定因素是
[? ]
A.元素原子半径大小呈周期性变化
B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列反应中,调节反应物用量或浓度不会改变生成物成分的是
A.木炭在氧气中燃烧
B.二氧化硫通入石灰水中
C.铁在氯气中燃烧
D.锌粉中加入硫酸
参考答案:C
本题解析:略
本题难度:一般
5、填空题 在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表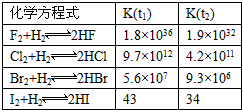
⑴已知t2>t1,HX的生成反应是________反应(填“吸热”或“放热”)。
⑵HX的电子式是________。
⑶共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是________。
⑷X2都能与H2反应生成HX,用原子结构解释原因:________________。
⑸K的变化体现出X2化学性质的递变性,用原子结构解释原因:________________,原子半径逐渐增大,得电子能力逐渐减弱。
⑹仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,________(选填字母)。
a. 在相同条件下,平衡时X2的转化率逐渐降低
b. X2与H2反应的剧烈程度逐渐减弱
c. HX的还原性逐渐减弱
d. HX的稳定性逐渐减弱
参考答案:⑴放热
⑵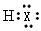
⑶HF、HCl、HBr、HI
⑷卤素原子的最外层电子数均为7
⑸同一主族元素从上到下原子核外电子层数依次增多
⑹ad
本题解析:
本题难度:一般