时间:2019-03-14 22:45:51
1、简答题 (1)下列有关中和滴定的操作:
①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤.
正确的操作顺序是______
(2)对于反应2L(g)+3M(g)?xQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2min后达平衡时生成2.4mol气体R,和0.8mol气体Q,则x的值为______,平衡时M的浓度是______,L的转化率为______,VR=______.
参考答案:(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,故答案为:③⑥①②⑤④
(2)经2min后达平衡时生成2.4mol气体R和0.8mol气体Q,
2L(g)+3M(g)?xQ(g)+3R(g),
起始量(mol)23 0 0
变化量(mol)1.62.4 0.8 2.4
平衡量(mol) 0.4 0.6 0.8 2.4
依据上式分析计算:
根据浓度变化量之比等于化学计量数之比可知:x=1;
平衡时M的浓度是0.6mol2L=0.3mol/L;
L的转化率为1.6mol2mol×100%=80%;
2min内R的反应速率2.4mol2L2min=0.6mol/(L?min),
故答案为:1;0.3mol/L;80%;0.6mol/(Lmin);
本题解析:
本题难度:简单
2、选择题 用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是?
[? ]
参考答案:A
本题解析:
本题难度:一般
3、简答题 草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4?xH2O表示,为了测定x值进行如下实验:
①称取1.260g纯草酸晶体,将其配制成100.00mL水溶液为待测液.
②取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.试回答:
(1)实验中需要用到的玻璃仪器有:滴定管、100mL量筒、烧杯、胶头滴管、锥形瓶、玻璃棒,其中还缺少的仪器有(填名称及规格)______.
(2)滴定时,将KMnO4标准液装在如图中的______(填“甲”或“乙”)滴定管中.达到滴定终点的现象是______.
(3)在滴定过程中若用去0.1000mol/L的KMnO4溶液10.00mL(已取三次平均值),则所配制的草酸溶液的物质的量浓度为______mol/L,由此可计算x的值是______.
(4)①若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得x值会______填“偏大”、“偏小”或“无影响”,下同).
②若滴定终点时仰视滴定管刻度,则由此测得的x值会______.
参考答案:(1)根据实验操作步骤可知,应需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等,所给仪器中缺少100mL容量瓶,
故答案为:100mL容量瓶;
(2)高锰酸钾具有强氧化性,应装在酸式滴定管中,草酸与酸性高锰酸钾发生氧化还原反应,当滴定到终点时,二者恰好完全反应,再滴入一滴KMnO4溶液变成紫色(或红色)且半分钟不褪色,可说明达到滴定终点,
故答案为:甲;滴入一滴KMnO4溶液变成紫色(或红色)且半分钟不褪色;
(3)n(KMnO4)=0.1000mol/L×0.01L=0.001000mol,设草酸浓度为c,则有0.025c:0.001000=5:2,
c=0.1000mol/L,
根据n=mM计算,有1.260g(90+18x)g/mol=0.1mol/L×0.1L,
解得x=2,
故答案为:0.1000;2;
(4)①滴定时为减小实验误差,应用少量蒸馏水将锥形瓶内壁冲洗,使草酸完全反应,所以用少量蒸馏水将锥形瓶内壁冲洗一下,对实验结果无影响,
故答案为:无影响;
②滴定终点时仰视滴定管刻度,会导致测量体积偏大,测定草酸质量偏大,则x值会偏小,故答案为:偏小.
本题解析:
本题难度:一般
4、选择题 用标准浓度的氢氧化钠溶液来滴定末知浓度的盐酸,在滴定操作时,盐酸一般放在( )
A.锥形瓶中
B.烧杯中
C.滴定管中
D.量筒中
参考答案:A
本题解析:
本题难度:一般
5、实验题 用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol·L-1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如下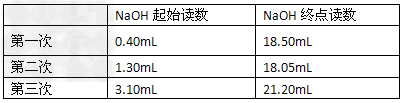
(1)达到滴定终点的时溶液颜色的变化为______色到_______色;? ?
(2)根据以上数据可以计算出盐酸的物质的量浓度为_____________;?
(3)以下操作造成测定结果偏高的原因可能是_____________。?
A、?滴定终点读数时,俯视滴定管的刻度,其它操作均正确 ?
B、?盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C、?滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D、?未用标准液润洗碱式滴定管
参考答案:(1)无;(浅)红?
(2)0.1448 mol/L?
(3)CD
本题解析:
本题难度:一般