时间:2018-03-17 08:48:12
1、选择题 下列物质属于电解质的一组是( )
A.CO2、NH3、HCl
B.H2SO4、NaOH、BaCl2
C.H3PO4、H2O、Cu
D.液态KNO3、NaOH溶液、C2H5OH
参考答案:B
本题解析:略
本题难度:一般
2、选择题 下列化合物在一定条件下既能发生消去反应,又能发生水解反应的是( ? )
A.CH3Cl
B.
C.
D.
参考答案:B
本题解析:
本题难度:简单
3、选择题 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合后,溶液pH>7,以下关系式错误的是A.c(A-)> c(HA) B.c(Na+)+c(H+)= c(A-)+c(Cl-)+c(OH-)
C.c(HA)+c(A-)=0.1mol/L D.c(Na+)= c(A-)+ c(HA)
参考答案:A
本题解析:将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合,发生反应:NaA+HCl=NaCl+HA。得到的是NaA、NaCl、HA等浓度等体积的混合溶液。由于此时溶液pH>7,说明NaA的水解作用大于HA的电离作用。所以c(A-)< c(HA)。A错误。根据电荷守恒可得c(Na+)+c(H+)= c(A-)+c(Cl-)+c(OH-)。正确。根据物料守恒可得c(HA)+c(A-)=0.1mol/L。正确。由于在物质NaA中n(Na+)=n(A-).A-在溶液中与酸发生反应变为HA。所以根据物料守恒及原子守恒可得c(Na+)= c(A-)+ c(HA)。正确。
考点:考查混合溶液中离子浓度的大小比较的知识。
本题难度:一般
4、填空题 (8分)⑴浓度均为0.1mol/L的8种溶液:① HNO3 ② H2SO4 ③ CH3COOH ④ Ba(OH)2 ⑤NaOH ⑥ CH3COONa ⑦ KCl ⑧ NH4Cl,溶液pH值由小到大的顺序是(填写编号) ________________。
(2)氯化铝水溶液呈 性,原 因是(用离子方程式表示): ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 (写化学式)。
因是(用离子方程式表示): ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 (写化学式)。
参考答案:(8分)
⑴②①③⑧⑦⑥⑤④ (2)酸,Al3++3H2O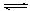 Al(OH)3+3H+,Al2O3
Al(OH)3+3H+,Al2O3
本题解析:略
本题难度:一般
5、选择题 下列有关物质用途的叙述中不正确的
A.碳酸氢钠可用于治疗胃酸过多
B.氧化铝可用于制耐火砖,坩埚等
C.硅是光导纤维和制造太阳能电池的主要原料
D.Al2(SO4)3和Fe2(SO4)3均可除去河水中的悬浮颗粒
参考答案:C
本题解析:分析:A、根据碳酸氢钠的用途;
B、根据氧化铝的用途;
C、根据硅和二氧化硅的用途;
D、根据Al2(SO4)3和Fe2(SO4)3的用途;
解答:A、碳酸氢钠可用于治疗胃酸过多、作发酵剂,故A正确;
B、氧化 铝可作耐火材料,用于制耐火砖,坩埚等,故B正确;
C、二氧化硅是光导纤维的主要原料,硅是制造太阳能电池的主要原料,故C错误;
D、Al2(SO4)3和Fe2(SO4)3均可作净水剂,除去河水中的悬浮颗粒,故D正确;
故选:D.
点评:本题主要考查了物质的用途,掌握物质的性质是解题的关键.
本题难度:一般