时间:2018-03-17 08:20:08
1、填空题 已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)=?。
(2)HA的电离平衡常数K=?;
(3)升高温度时,K?(填“增大”,“减小”或“不变”)。
(4)由HA电离出的c(H+)约为水电离出的c(H+)的?倍。
参考答案:(1)1.0×10 91exam .org-4 mol/L
(2)1×10-7
(3)增大 (4)106
本题解析:(1)HA电离出的c(H+)=0.1×0.1% mol/L=1×10-4 mol/L;
(2)电离平衡常数
K= =
=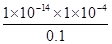 =1×10-7;
=1×10-7;
(3)因HA的电离是吸热过程,升高温度c(H+)、c(A-)均增大,则K增大;
(4)c(H+)HA=1×10-4 mol/L,c(H+)水=c(OH-)= =1×10-10 mol/L,所以c(H+)HA∶c(H+)水=(1×10-4)∶(1×10-10)=106。
=1×10-10 mol/L,所以c(H+)HA∶c(H+)水=(1×10-4)∶(1×10-10)=106。
本题难度:一般
2、选择题 能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是( )
①将水加热煮沸?
②向水中投入一小块金属钠?
③向水中通CO2④向水中通NH3?
⑤向水中加入明矾晶体?
⑥向水中加入NaHCO3固体
⑦向水中加NaHSO4固体.
A.①③⑥⑦
B.①③⑤⑥
C.⑤⑦
D.⑤
参考答案:①加热时能促进水的电离,但是c(H+)=c(OH-),溶液呈中性,故①错误;
②加入金属钠,和水电离出的氢离子反应生成氢氧化钠和氢气,从而促进水的电离,但溶液中c(H+)<c(OH-),故②错误;
③二氧化碳溶于水生成碳酸,溶液中的c(H+)>c(OH-),但酸对水的电离起抑制作用,故③错误;
④NH3?溶于水生成氨水,溶液中的c(H+)<c(OH-),导致溶液呈碱性,且氨水抑制水电离,故?④错误;?
⑤向水中加入明矾,铝离子水解对水的电离起促进作用,电离后的溶液显酸性,溶液中的c(H+)>c(OH-),故⑤正确;?
⑥向水中加入NaHCO3,碳酸氢钠中的碳酸氢根水解而使溶液显碱性,即溶液中的c(H+)<c(OH-),故⑥错误;
⑦向水中加NaHSO4固体,硫酸氢钠在水中完全电离出钠离子、氢离子、硫酸根离子,溶液中的c(H+)>c(OH-),但氢离子抑制水电离,故⑦错误,
故选D.
本题解析:
本题难度:简单
3、选择题 下列有关溶液中相关量的关系描述不正确的是( )
A.pH=2的盐酸和pH=2的醋酸溶液混合后:pH=2
B.100mL1.0?mol?L-1Fe(NO3)2溶液和100mL2.0?mol?L-1?HNO3溶液混合后:c(NO3-)=2.0?mol?L-1
C.pH相等的CH3COONa、NaClO、NaHCO3三种溶液:c(CH3COONa)>c(NaHCO3)>c(NaClO)
D.0.1?mol?L-1的KHA溶液,其pH=10:c(HA-)>c(OH-)>c(H+)>c(A2-)
参考答案:A、在醋酸的电离平衡移动之前,H+浓度显然未变,而因体积增大,Ac-和HAc浓度以相同的比例减小了,即c(Ac-)和c(HAc)的比值是不变的,所以c(H+)?c(Ac-)和c(HAc)的比值没有发生改变,显然电离平衡也就不需要移动了,pH仍是2,故A正确;
B、溶液中的亚铁离子要和HNO3发生氧化还原反应,一部分硝酸根离子被还原为一氧化氮,所以c(NO3-)<2.0 mol?L-1,故B错误;
C、同浓度的NaHCO3、CH3COONa、NaClO,阴离子的水解程度大小依次是:ClO->HCO3->CH3COO-,pH由大到小的顺序为NaClO>NaHCO3>CH3COONa,故在他们的pH相同时,浓度大小顺序应为c(CH3COONa)>c(NaHCO3)>c(NaClO),故C正确;
D、0.1?mol?L-1的KHA溶液,其pH=10,证明HA-的水解程度大于电离程度,所以c(HA-)>c(OH-)>c(H+)>c(A2-),故D正确.
故选B.
本题解析:
本题难度:简单
4、选择题 以下说法正确的是?
[? ]
A.将pH=4的醋酸溶液稀释后,H+浓度增大
B.常温下,0.01LpH=10的NaOH溶液加水稀释到10L,此时溶液的PH=7
C.改变条件使醋酸的电离平衡向右移动,醋酸的电离度一定增大
D.常温下0.1mol·L-1醋酸溶液的pH=a,加入适量的醋酸钠固体能使溶液pH=(a+1)
参考答案:D
本题解析:
本题难度:一般
5、选择题 有关常温下pH均为3的醋酸和硫酸的说法正确的是
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
参考答案:A
本题解析:醋酸和硫酸溶液中的水电离出的氢离子和氢氧根离子的浓度相等,水电离出的氢离子就等于溶液中的氢氧根离子,pH均为3时溶液中氢离子的溶度为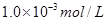 ,根据水的离子积可以得到
,根据水的离子积可以得到 ,A正确;加水稀释相同的倍数由于醋酸是弱酸稀释的过程中会电离出氢离子,而硫酸溶液中没有此过程,所以稀释相同的倍数时硫酸的PH变化较大,醋酸的PH变化较小,B错误;醋酸是一元酸,硫酸时二元酸当二者的PH相同时,溶液中
,A正确;加水稀释相同的倍数由于醋酸是弱酸稀释的过程中会电离出氢离子,而硫酸溶液中没有此过程,所以稀释相同的倍数时硫酸的PH变化较大,醋酸的PH变化较小,B错误;醋酸是一元酸,硫酸时二元酸当二者的PH相同时,溶液中 ,C错误;由于醋酸中还有没有电离的醋酸分子所以当加入足量的锌片后醋酸产生的氢气比硫酸多,D错误;所以答案选A。
,C错误;由于醋酸中还有没有电离的醋酸分子所以当加入足量的锌片后醋酸产生的氢气比硫酸多,D错误;所以答案选A。
本题难度:简单