时间:2018-03-17 08:16:51
1、简答题 现要配制500mL、0.2mol?L-1的硫酸溶液
(1)需用质量分数为98%、密度为1.84g?cm-3的浓硫酸______mL.
(2)完成该实验需要的玻璃仪器主要有烧杯、量筒、______、______、______
(3)下列操作使所配溶液的物质的量浓度偏高的是______
A.往容量瓶中转移溶液时,有少量液体溅出.
B.未洗涤烧杯
C.定容时俯视刻度线
D.洗净容量瓶未干燥即用来配制溶液
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
参考答案:(1)浓硫酸的浓度C=1000ρwM=1000×1.84×98%98mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.2/L×0.5L,V=0.0054L=5.4mL,
故答案为:5.4;
(2)500mL容量瓶用来配制溶液,用玻璃棒引流液体,用胶头滴管定容,故答案为:500ml容量瓶、玻璃棒、胶头滴管;
(3)A.往容量瓶中转移溶液时,有少量液体溅出,溶质的物质的量偏小,配制溶液浓度偏低;
B.未洗涤烧杯,导致溶质的物质的量偏小,配制溶液浓度偏低;
C.定容时俯视刻度线,导致溶液体积偏小,配制溶液浓度偏高;
D.洗净容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液的体积都无影响,所以配制溶液浓度无影响;
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,溶液的体积偏大,配制溶液浓度偏低;
故选C.
本题解析:
本题难度:一般
2、实验题 实验室用氯化钠固体配制1.00mol·L-1的NaCl溶液0.5L,回答下列问题:
(1)配制上述溶液所需NaCl固体的质量为__________。
(2)请写出该实验的实验步骤 ①计算,②__________,③__________,④__________,⑤洗涤 ⑥
__________,⑦ 摇匀。
(3)所需仪器为:容量瓶(规格:__________)、托盘天平。还需要哪些玻璃仪器才能完成该实验,请写出:________________________________________。
(4)试分析下列操作对所配溶液的浓度有何影响。(填空:A---偏高.B---偏低.C---无影响,填序号) ①为加速固体溶解,可稍微加热并不断搅拌。在未降至室温时,立即将溶液转移至容量瓶定容。 __________;
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响
__________;
③ 配制前容量瓶用水洗涤后未进行干燥处理__________;
④定容时俯视刻度线__________。
参考答案:
(1)29.3g
(2)称量;溶解;转移;定容
(3)500ml;量筒、烧杯、玻璃棒、胶头滴管
(4)①A;②B;③C;④A
本题解析:
本题难度:一般
3、选择题 在标况下,将V?L?A气体(摩尔质量M?g/mol)溶于1L水中,所得A的水溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为
A.
B.
C.
D.
参考答案:A
本题解析:分析:标准状况下,Vm=22.4L/mol,n=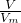 来计算气体的物质的量,利用m=n×M来计算气体的质量,溶剂和溶质的质量和为溶液的质量,利用V=
来计算气体的物质的量,利用m=n×M来计算气体的质量,溶剂和溶质的质量和为溶液的质量,利用V=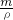 来计算溶液的体积,最后利用c=
来计算溶液的体积,最后利用c=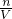 来计算该溶液的物质的量浓度.
来计算该溶液的物质的量浓度.
解答:标准状况下,Vm=22.4L/mol,气体的物质的量为n=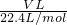 ;
;
气体的质量=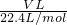 ×Mg/mol=
×Mg/mol=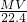 g;
g;
水的质量为1000mL×1g/mL=1000g,
即溶液的质量为1000g+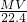 g;
g;
则溶液的体积=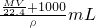
溶液的物质的量浓度=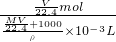 =
=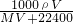 mol/L.
mol/L.
故选A.
点评:本题考查学生利用物质的量浓度的定义式计算,明确溶液中的溶质的物质的量及溶液的体积即可计算,溶液的体积计算是解答本题的关键,并注意本题中应按照气体与水不反应来分析.
本题难度:困难
4、选择题 实验中需用1.0 mol·L-1的CuSO4溶液950 mL,配制时选用容量瓶的规格和称取药品的质量分别为
[? ]