时间:2018-03-17 07:54:14
1、选择题 除去NaCl中混有的 MgCl2、Na2SO4时选用(?)
A.NaOH、Ba(NO3) 2、Na2CO3、HCl
B.Ca(OH) 2、Mg(NO3) 2、Na2CO3、HCl
C.NaOH、BaCl2、Na2CO3、HCl
D.Na2CO3、BaCl2、HCl
参考答案:C
本题解析:NaCl中混有MgCl2、Na2SO4,除去Mg2+要用OH-,除去SO42-要用Ba2+,新引入的OH-要用H+除去,新引入的SO42-要用CO32-除去,再引入的CO32-则用H+除去,故碳酸钠需在氯化钡之后加入,盐酸需在最后加入。-
点评:提纯除杂是化工生产中必不可少的工序,更是高考的考查重点。考生应着重复习此知识点。常考题型为选择题和实验题。
本题难度:简单
2、实验题 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 go。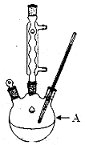
实验流程:
①往装置A中加入2.7mL (2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL、甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示列举
请回答:
(1)装置A的名称?。若不用温度计,本实验控制反应温度的措施为?。
(2)白色粗产品中除了KCl外,其他可能的无机杂质为____?。
(3)操作I的名称?。
(4)步骤③中用到的定量仪器有?,100mL容量瓶,50mL酸式、碱式滴定管。
(5)样品中苯甲酸纯度为?。
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果?(填“偏大”、“偏小”或“不变”)。
参考答案:(1)三颈烧瓶(1分),沸水浴加热或者加热保持反应液处于沸腾(2分,仅答水浴加热得1分)
(2)MnCl2(2分)
(3) 过滤、干燥或抽滤(2分)
(4)分析天平(2分)
(5) 0.9600或96.00%(2分)? (6)偏小(2分)
本题解析:(1)本实验控制反应温度约在100℃,可以采用水浴加热。(2)实验使用了KMnO4做氧化剂,白色粗产品中除了KCl外,还有MnCl2。(3)从混合液中得到沉淀一般采用过滤、干燥,也可以采用抽滤的方法。(4)步骤③的称量需要精确度高的分析天平才能保证精确度。
(5)舍弃第三次数据,平均消耗体积为24.00mL,又 ~NaOH,滴定的n(
~NaOH,滴定的n( )= 0.1000mol/L×24.00×10-3L=2.400×10-3 mol;而配制溶液用的是测定的4倍,即测定含样品0.3050g,所以,样品中苯甲酸纯度为
)= 0.1000mol/L×24.00×10-3L=2.400×10-3 mol;而配制溶液用的是测定的4倍,即测定含样品0.3050g,所以,样品中苯甲酸纯度为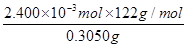 =0.9600。
=0.9600。
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视,两次度数距离偏小,测定结果也偏小。
本题难度:一般
3、选择题 甲、乙、丙、丁分别是氢氧化钙溶液、硝酸钾溶液、碳酸钠溶液、盐酸溶液中的一种,甲和丙可以反应,甲和丁也可以反应。则下列说法正确的是(?)
A.甲一定是氢氧化钙
B.乙一定是硝酸钾溶液
C.丙不可能是碳酸钠溶液
D.丁只能是盐酸
参考答案:B
本题解析:由题意可知:Ca(OH)2、Na2CO3、HCl都可以和另外的两种物质发生反应,因此它们都可以是甲、丙、丁。没有涉及的物质KNO3就是乙。
本题难度:一般
4、选择题 只用一种试剂鉴别正己烷、1-己烯、乙醇、苯酚水溶液4种无色液体,选
A.酸性KMnO4溶液
B.饱和溴水
C.NaOH溶液
D.AgNO3溶液
参考答案:B
本题解析:A不正确,酸性高锰酸钾溶液只和正己烷不反应,其余都是褪色。溴水和正己烷不反应,但分层,和1-己烯发生加成反应,和乙醇互溶,和苯酚生成白色沉淀,B正确。CD都是错误的,答案选B。
本题难度:一般
5、填空题 V2O5是接触法制硫酸的重要催化剂,工业上生产V2O5的工艺流程如下:请回答下列问题:
(1)步骤①所得废渣的成分是?(写化学式),它与NaOH溶液反应的离子反应方程式为?。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4(水层),
2RAn(有机层)+nH2SO4(水层),
①实验室中步骤②、③使用的主要仪器是?。
②中萃取时必须加入适量碱,其原因是?。
(3)步骤③中X试剂为?,步骤④的目的是?,步骤⑤的离子方程式为?。
(4)该工艺流程中,可以循环利用的物质有?和??。
参考答案:(1)SiO2? SiO2+2OH?=SiO32?+H2O
(2)①分液漏斗
②加入碱中和硫酸,促进平衡正向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量等]
(3)H2SO4?将VO2+氧化为VO3-? NH3?H2O+ VO3-=NH4VO3↓+OH?
(4)氨气(或氨水)?有机萃取剂
本题解析:(1)SiO2不溶于水,所以步骤①所得滤渣的成分是SiO2;SiO2为酸性氧化物,与NaOH反应生成Na2SiO3,离子方程式为:SiO2+2OH?=SiO32?+H2O
(2)① 步骤②为萃取,步骤③为反萃取,用到的主要仪器为分液漏斗
②步骤②中存在平衡:R2(SO4)n(水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4(水层),加入适量碱中和硫酸,促进平衡正向移动,提高钒的萃取率。
2RAn(有机层)+nH2SO4(水层),加入适量碱中和硫酸,促进平衡正向移动,提高钒的萃取率。
(3)步骤③为反萃取,得到的水溶液含VO2+、SO42?,所以X试剂为H2SO4;根据化学流程图,步骤④加入强氧化剂KClO3,将VO2+氧化为VO3-;步骤⑤加入NH3?H2O生成NH4VO3沉淀,所以离子方程式为:NH3?H2O+ VO3-=NH4VO3↓+OH?
(4)步骤⑤需加入氨水,步骤⑥生成氨气,所以氨气(或氨水)可循环利用,步骤②为萃取,步骤③为反萃取,所以有机萃取剂也可以循环利用。
本题难度:一般