时间:2018-03-17 07:50:48
1、填空题 (12分)某研究性学习小组探究醋酸的溶液情况,进行了如下实验。
(1)取一定量的冰醋酸配制250 mL 0.5000 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___________和___________。
(2)用上述0.5000 mol·L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对25.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 25.05 | 25.00 | 23.80 | 24.95 |
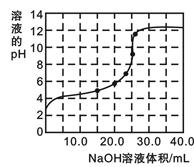
参考答案:(1)250mL容量瓶(2分,写容量瓶不给分)胶头滴管(2分)(2)0.2000mol·L-1(2分)
(3)①c(CH3COO-)>c(Na+)>c(H+)>c(OH-)(2分) ②100(2分) 10-9(2分)
本题解析:(2)配置一定物质的量浓度的溶液值一定要用到容量瓶,溶液需要250mL,故选用250mL容量瓶来,在定容的时候还要用到胶头滴管。(2)在四组数据中第3组相差太大,要舍去,消耗NaOH溶液的体积为:(22.05+25.00+24.95)÷3="25.00" mol,根据c(NaOH)×V(NaOH)=c(CH3COOH)×V(CH3COOH),0.2000 mol·L-1×25.00 mol= c(CH3COOH)×25.00 mL,得c(CH3COOH)=0.2000mol·L-1。(3)①滴加12.50mLNaOH时CH3COOH没有完全反应,CH3COOH过量,溶液显酸性,离子浓度大小顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。②当滴加25.00mLNaOH时CH3COOH完全反应,生成CH3COONa,CH3COO-水解使得溶液显碱性,pH=9时c(H+)=10-9mol·L-1,则c(OH-)=10-5mol·L-1,此时的OH-都是由水电离出来的,纯水电离的c(OH-)=10-7mol·L-1,是纯水电离程度的100倍。根据电荷守恒和物料守恒有c (OH-) +c (CH3COO-) =c(H+)+ c(Na+),c(Na+)= c(CH3COO-)+ c(CH3COO-),则有c (OH-) -c (CH3COOH)=c(OH-)=10-9mol·L-1
考点:溶液的配制、离子浓度的浓度大小比较和离子浓度的计算。
本题难度:困难
2、选择题 常温下,有关下列4种溶液的说法正确的是( )
| ① | ② | ③ | ④ 0.1mol?L-1氨水 Ph=11 氨水 0.1mol?L-1 盐酸 pH=3 盐酸 |
参考答案:A.酸和碱抑制水的电离,氢离子或氢氧根的浓度越大,水的电离程度越小;0.1mol?L-1氨水电离出来的氢氧根的浓度小于0.1mol?L-1盐酸电离的氢离子浓度,所以对水的电离抑制程度小,则由水电离出的c(H+):①>③,故A错误;
B.一水合氨是弱电解质,在溶液中部分电离,0.1mol?L-1氨水中PH<13,所以①稀释到原来的100倍,pH与②不相同,故B错误;
C.①与③混合,若溶液pH=7,由溶液中电荷守恒可知:c(NH4+)+c(H+)=C(Cl-)+c(OH-),因为c(H+)=c(OH-),所以c(NH4+)=C(Cl-),故C错误;
D.一水合氨是弱电解质,在溶液中一水合氨的浓度大于氢氧根离子的浓度,所以Ph=11氨水的浓度大于10-3mol?L-1,因此②与④等体积混合时,氨水过量,溶液显碱性,混合液pH>7,故D正确.
故选D.
本题解析:
本题难度:简单
3、选择题 人体血液的正常pH约为7.35~7. 45,若在外界因素作用下突然发生改变就会引起“酸中毒” 或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
H++HCO3-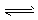 H2CO3
H2CO3 CO2+H2O,H++PO43-
CO2+H2O,H++PO43- HPO42-?, H++HPO42-
HPO42-?, H++HPO42-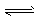 H2PO4- 故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是
H2PO4- 故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是
[? ]
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注了大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小
参考答案:C
本题解析:
本题难度:一般
4、选择题 相同条件下,等体积、等pH的醋酸溶液和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积为下列的
A.仍相同
B.醋酸溶液的大
C.盐酸的大
D.无法判断
参考答案:B
本题解析:
本题难度:一般
5、填空题 (4分)今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:
A.①>②>③
B.①<②<③
C.①=②=③
D.①=③>②
E.①>②=③ F.①<②=③ G.①=②<③ H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是 。
(2)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为 。
(3)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为 。
(4)将pH相同的三种酸均稀 释10倍后,pH关系为 。
参考答案:A、B、E、F
本题解析:(1)当溶液中氢离子浓度相同,假设提供1mol/L的氢离子,需要醋酸浓度应大于1mol/L,需要盐酸溶液浓度为1mol/L,H2SO4溶液浓度为0.5mol/L,所以其物质的量浓度由大到小排列的是:①>②>③;(2)体积和浓度相同的①、②、③三溶液,假设溶质为1mol,分别与同浓度的烧碱溶液反应,要使反应后溶液的pH为7,①CH3COOH是弱酸,恰好中和生成醋酸钠溶液呈碱性,所以需要烧碱小于1mol;②和1molH氢氧化钠恰好反应溶液呈中性;③1molH2SO4和2mol恰好反应需要氢氧化钠2mol; 所需烧碱溶液的体积由大到小关系为③>②>①;(3) pH相同即它们溶液中c(H+)相同、体积相同时,分别加入足量锌,氢元素的物质的量越多,生成氢气则越多,所以醋酸生成氢气最多,盐酸和硫酸生成氢气相同,所以气体体积大小顺序是:①>②=③;(4) 将溶液中c(H+)相同的三种酸均稀释10倍后,醋酸中存在电离平衡,所以加水稀释促进醋酸电离,硫酸和氯化氢都是强电解质,加水稀释改变氢离子个数,所以氢离子浓度相等,醋酸中氢离子浓度最大,则氢离子浓度大小顺序是①>②=③,pH关系为①<②=③。
考点:考查弱电解质在水溶液中的电离平衡。
本题难度:一般