时间:2018-03-17 07:27:01
1、选择题 下列物质中不能用化合反应的方法制的的是
①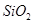 ?②
?②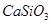 ?③
?③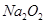 ?④
?④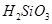 ?⑤
?⑤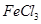 ?
?
A.①③⑤
B.②④
C.②
D.④
参考答案:D
本题解析:不能用化合反应的方法制的是: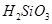 ,硅酸的制备:可溶性硅酸盐和强酸反应。故选D。
,硅酸的制备:可溶性硅酸盐和强酸反应。故选D。
点评:本题考查的是常见无机化合物的性质及其用途,难度不大,掌握好基础知识很容易解得本题。
本题难度:简单
2、简答题 化学中用类比的方法可预测许多物质的性质,如根据H2+Cl2═2HCl,推测:H2+Br2═2HBr,但类比是相对的,如根据2Na2O2+2CO2═2Na2CO3+O2类推2Na2O2+2SO2═2Na2SO3+O2是错误的,应该为Na2O2+SO2═Na2SO4.
(1)下列各组类比中正确的为______.
A.由元素周期表中Al和Ge元素的相似性,推测钙(Ca)元素与铷(Rb)元素性质相似
B.由NH4Cl═NH3↑+HCl↑推测NH4I═NH3↑+HI↑
C.由2CO2+Ca(ClO)2+2H2O═Ca(HCO3)2+2HClO推测CO2+NaClO+H2O═NaHCO3+HClO
D.由Fe3O4+8HCl═FeCl2+2FeCl3+4H2O推测Pb3O4与浓盐酸反应的化学方程式为:Pb3O4+8HCl(浓)═2PbCl2+PbCl4+4H2O
(2)根据月球中用N元素代替O元素的事实,推测地球上的葡萄糖的结构简式[CH2OH(CHOH)4CHO]在月球上应为______.
(3)从2F2+2H2O═4HF+O2反应预测2F2+4NaOH═4NaF+2H2O+O2.然而经实验,在某条件下,物质的量相等的F2和NaOH恰好完全反应,生成氟化钠、水和一种气体,请根据实验结果写出反应的化学方程式______.
参考答案:(1)A、元素周期表中,Al和Ge元素处于对角线位置,元素性质相似,但是钙(Ca)元素与铷(Rb)元素不具备该种位置关系,故A错误;
B、由NH4Cl═NH3↑+HCl↑推测NH4I═NH3↑+HI↑,但是碘化氢受热易分解为碘单质和氢气,所以碘化铵受热分解的产物是氨气、碘蒸气和氢气,故B错误;
C、碳酸酸性强于次氯酸,并且过量二氧化碳参加反应对应产物是碳酸氢盐,由2CO2+Ca(ClO)2+2H2O═Ca(HCO3)2+2HClO推测CO2+NaClO+H2O═NaHCO3+HClO,故C正确;
D、铅的化合物中+4价的铅不稳定,Pb3O4与浓盐酸反应的化学方程式为:Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O,故D错误.
故选C.
(2)将葡萄糖的结构简式[CH2OH(CHOH)4CHO]中的氧元素改为氮元素,氮元素周围满足三价键理论,结果为:H2NCH2(CHNH2)CH=NH,故答案为:H2NCH2(CHNH2)CH=NH;
(3)物质的量相等的F2和NaOH恰好完全反应,生成氟化钠、水和一种气体,先根据水中氢原子和氢氧化钠中氢原子的数目关系确定氟气和氢氧化钠均为2mol,根据原子守恒确定气体是OF2,故答案为:2F2+2NaOH=2NaF+OF2+H2O.
本题解析:
本题难度:一般
3、选择题 下列各组物质的性质比较正确的是( )
A.酸性:HClO4>H2SO4>H3PO4
B.稳定性:H2S>HCl>HBr>HI
C.碱性:KOH<NaOH<LiOH
D.熔点:SiO2>Na>NaCl
参考答案:A.同周期自左而右非金属性减弱,非金属性越强最高价含氧酸的酸性越强,酸性:HClO4>H2SO4>H3PO4,故A正确;
B.同主族自上而下非金属性减弱,碘可以氧化硫离子为硫单质,故非金属性,Cl>Br>I,非金属性越强氢化物越稳定,但硫化氢的稳定性高于碘化氢,故稳定性HCl>HBr>H2S>HI,故B错误;
C.同主族自上而下金属性增强,金属性越强最高价氧化物对应水化物的碱性越强,故碱性:KOH>NaOH>LiOH,故C错误;
D.SiO2是原子晶体,NaCl是离子晶体,钠的熔点很低,比氯化钠低,故熔点SiO2>NaCl>Na,故D错误;
故选A.
本题解析:
本题难度:简单
4、简答题 下表列出了①~⑥六种元素在周期表中的位置:
| ?族 周期 | 0 1 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2 ① ② 3 ③ ④ ⑤ ⑥ ⑦ ⑧ | |||||||
参考答案:由元素在周期表中的位置可知,①为C元素、②为N元素、③为Na元素、④为Al元素、⑤为Si元素、⑥为P元素、⑦为S元素、⑧为Cl元素,
(1)PH3中P原子与H原子之间形成1对共用电子对,电子式为
,故答案为:
;
(2)同周期自左而右原子半径减小,故原子半径最小的元素是Cl,故答案为:Cl;
(3)Al(OH)3是两性氢氧化物,同周期自左而右非金属性增强,故非金属性Si<P<S<Cl,非金属性越强,最高价氧化物的水化物酸性越强,故酸性HClO4>H2SO4>H3PO4>H2SiO3,
故答案为:Al(OH)3;HClO4>H2SO4>H3PO4>H2SiO3;
(4)实验室利用氯化铵与氢氧化钙加热制备氨气,反应方程式为2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O;
(5)钠与水反应生成氢氧化钠,铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为2A1+2OH-+2H2O=2A1O2-+3H2↑,
故答案为:2A1+2OH-+2H2O=2A1O2-+3H2↑.
本题解析:
本题难度:一般
5、选择题 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是 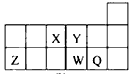
[? ]
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C.离子Y2-和Z3+的核外电子数和电子层数都相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
参考答案:AC
本题解析:
本题难度:一般