时间:2018-03-17 07:26:02
1、选择题 用a、b两个质量相等的Pt电极电解AlCl3和CuSO4的混合溶液[n(AlCl3)∶n(CuSO4)=1∶9]。t1时刻a电极得到混合气体,其中Cl2在标准状况下为224 mL(忽略气体的溶解);t2时刻Cu全部在电极上析出。下列判断正确的是(?)
A.a电极与电源的负极相连
B.t2时,两电极的质量相差3.84 g
C.电解过程中,溶液的pH不断增大
D.t2时,b的电极反应是4OH--4e-=2H2O+O2↑
参考答案:B
本题解析:根据a电极得到氯气,即2Cl--2e-=Cl2↑,则电极a为阳极,与电源的正极相连,A错;n(Cl2)="0.01" mol,则n(Cl-)="0.02" mol,n(AlCl3)="0.02/3" mol,则n(CuSO4)="0.06" mol,t2时,阴极b上铜离子完全析出,其电极质量增加0.06 mol×64 g/mol="3.84" g,B项正确;刚开始时Cl-和Cu2+放电(相当于电解CuCl2:0.01 mol),溶液的pH不变,当Cl-放电结束后,则是OH-和Cu2+放电(相当于电解CuSO4:0.05 mol,方程式为:2CuSO4+2H2O=2Cu+2H2SO4+O2↑),此时由于消耗OH-而溶液的酸性增强;t2时刻,Cu2+放电完毕,a、b两极分别是OH-和H+放电,相当于电解Al2(SO4)3(实质是电解H2O),溶剂减少,b电极的电极反应是2H++2e-=H2↑,c(H2SO4)增大,所以酸性增强。
本题难度:一般
2、填空题 将铝制品与另一种材料作电极,以某种溶液作电解液进行电解,通电后在铝制品与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝制品表面形成一层较厚的氧化膜。某校研究性学习小组根据上述原理,以铝制品和铁棒为电极,一定浓度的NaHCO3溶液为电解液进行实验。
(1)铝制品表面形成氢氧化铝薄膜的电极反应式为________________。
(2)电解过程中,必须使电解液的pH保持相对稳定(不能太大,也不能太小)的原因是_______________________________。
(3)使用NaHCO3溶液为电解液,会减缓阴极区溶液pH值的增大,能说明这一原理的离子方程式为
_____________________
参考答案:(1)Al-3e-+3HCO3-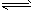 Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
(2)Al(OH)3和Al2O3都是两性物质,当电解液呈酸性或强碱性时,刚形成的Al2O3薄膜会被电解液溶解
(3)HCO3-+OH-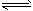 CO32-+H2O
CO32-+H2O
本题解析:
本题难度:一般
3、选择题 1L溶液中含有下列离子,用Pt电极电解该溶液,当电路中有3mol?e-通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是( )
| 离子 | Cu2+ | Al3+ | NO3- | Cl- 物质的量浓度(mol/L) 1 1 a 1 |
参考答案:依据电解过程中存在电子守恒,结合电极反应计算分析产物,用Pt电极电解该溶液,当电路中有3mol e-通过时
阳极电极反应为:2Cl--2e-=Cl2↑;
?1mol?1mol?1mol?
? 4OH--4e-=2H2O+O2↑
?2mol?2mol? 1mol?
阴极电极反应为:Cu2++2e-=Cu
?1mol?2mol 1mol
? ?2H++2e-=H2↑
? 1mol 1mol 0.5mol
A、电解后溶液PH计算,依据两电极上的反应计算,阳极减少2mol氢氧根离子,同时阴极上减少1mol氢离子,综合计算分析得到溶液中增加氢离子物质的量为1mol,氢离子浓度为1mol/L,pH=0,故A正确;
B、依据溶液中电荷守恒计算忽略氢离子和氢氧根离子浓度:2c(Cu2+)+3c(Al3+)=c(Cl-)+c(NO3-),计算得到c(NO3-)=4mol/L,故B错误;
C、依据电极反应电子守恒可知阳极生成1molCl2,故C错误;
D、阴极析出的金属是铜,无金属铝析出,故D错误;
故选A.
本题解析:
本题难度:简单
4、填空题 (6分)(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g)ΔH="+206.0" kJ·mol-1
CO(g)+3H2(g)ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g) CH3OH(g)ΔH="-129.0" kJ·mol-1
CH3OH(g)ΔH="-129.0" kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 _____________。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+ 氧化成Co3+,然后以Co3+ 作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
①写出阳极电极反应式 _______ 。
②写出Co3+除去甲醇的离子方程式 。
参考答案:(6分) (1) CH4(g)+H2O(g) CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1
CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1
(2)①Co2+ — e-  Co3+ ②6Co3++CH3OH+H2O
Co3+ ②6Co3++CH3OH+H2O CO2↑+6Co2++6H+
CO2↑+6Co2++6H+
本题解析:(1)根据盖斯定律,I+II可得所求的热化学方程式,所以CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为CH4(g)+H2O(g) CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1;
CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1;
(2)①阳极发生氧化反应,则Co2+ 被氧化成Co3+,电极反应式为Co2+ — e-  Co3+;
Co3+;
②Co3+ 作氧化剂把水中的甲醇氧化成CO2而净化,本身又被还原为Co2+,所以Co3+除去甲醇的离子方程式是6Co3++CH3OH+H2O CO2↑+6Co2++6H+。
CO2↑+6Co2++6H+。
考点:考查离子方程式的书写,盖斯定律的应用
本题难度:一般
5、填空题 (15分)资源化利用CO2不仅可以减少温室气体的排放,还可以重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式为:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0kJ/mol,该反应中每生成1mol Fe3O4,转移电子的数目为 。
(2)在一定条件下,二氧化碳转化为甲烷的反应为:CO2(g)+4H2(g)  CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0
①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol/L, H2 0.8 mol/L, CH4 0.8 mol/L, H2O 1.6 mol/L。起始充入CO2和H2的物质的量分别为 、 。CO2的平衡转化率为 。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1mol CO2和4molH2,在Ⅱ中充入1mol CH4和2molH2O(g),300℃开始反应,达到平衡时,下列说法正确的是( )(填字母)。
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中反应的平衡常数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如下图所示:
①上述生产过程的能量转化方式是 、 。
②上述电解反应在温度小于900℃时进行,碳酸钙分解为CaO和CO2,电解质为熔融碳酸钠,则阳极电极反应式为 ,阴极电极反应式为 。
参考答案:(15分)(1)2NA (2)①2mol ,8mol ,80
本题解析:
本题难度:困难