时间:2018-03-17 07:23:22
1、选择题 目前已研制出一种用磺酸类质子作溶剂的酸性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O。下列关于该电池的说法正确的是
A.通入乙醇的电极为该电池的正极
B.放电过程中,电源内部的H+从正极区向负极区迁移
C.该电池的正极反应为:4H++O2+4e—=2H2O
D.用该电池做电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2 mol C2H5OH,阴极产生标准状况下气体的体积为13.44 L
参考答案:C
本题解析:乙醇作为一种燃料,在反应中失去电子,被氧化,因此在燃料电池中乙醇在负极上发生反应,A错误;负极失去电子,电子沿导线传递到正极上,因此溶液中的阳离子向正极移动,阴离子向负极移动B错误;氧气在正极反应,C正确;乙醇中碳原子的化合价是+2价,而在产物中碳原子的化合价是+4价,即1个碳原子失去6个电子,所以1mol乙醇转移12mol电子,消耗0.2mol乙醇转移2.4mol电子,电解池的阴极生成氢气,生成氢气的物质的量为x,根据转移电子数守恒,2x=2.4mol,x=1.2mol,故生成氢气的体积为1.2molx22.4L/mol=26.88L,D错误,答案选C.
考点:电解池和原电池原理
本题难度:困难
2、选择题 硫化氢(H2S)是一种有毒的可燃性气体,用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为2H2S+3O2+4KOH=2K2SO3+4H2O。
(1)该电池工作时正极应通入?。
(2)该电池的负极电极反应式为:?。
(3)该电池工作时负极区溶液的pH?(填“升高”“不变”“降低”)
(4)有人提出K2SO3可被氧化为K2SO4,因此上述电极反应式中的K2SO3应为K2SO4,某学习小组欲将电池工作一段时间后的电解质溶液取出检验,以确定电池工作时反应的产物。实验室有下列试剂供选用,请帮助该小组完成实验方案设计。
0.01mol·L-1KMnO4酸性溶液,1mol·L-1HNO3,1mol·L-1H2SO4,1mol·L-1HCl,
0.1mol·L-1Ba(OH)2,0.1 mol·L-1 BaCl2。
| ? | 实验步骤 | 实验现象及相关结论 |
| ① | 取少量电解质溶液于试管中,用pH试纸测其pH。 | 试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH。 |
| ② | 继续加入?溶液,再加入 ?溶液,振荡。 | 若有白色沉淀产生,则溶液中含有K2SO4。 若无白色沉淀产生,则溶液中没有K2SO4。 |
| ③ | 另取少量电解质溶液于试管中,先加 1 mol·L-1的H2SO4酸化,再滴入2~3滴0.01 mol·L-1KMnO4酸性溶液,振荡。 | ? ?; ? ?。 |
参考答案:(12分)(1)空气(或氧气) (1分)
(2)2H2S+16OH-—12e-=2SO32-+10H2O?或H2S+8OH-—6e-=SO32-+5H2O(3分)
(3)降低(1分)
(4)①足量1mol·L-1 HCl (1分)?少量0.1 mol·L-1 BaCl2(1分)
②若KMnO4溶液紫红色褪去,则说明溶液中含有K2SO3,若KMnO4溶液紫红色不褪,则说明溶液不含K2SO3(2分)。
(5)5.000 mol·L-1(3分)
【由于BaSO3在空气中加热时转化为BaSO4,
n(BaSO4)=11.65g/233g?mol-1=0.05000mol,即n(K2SO4)+n(K2SO3)=0.05000mol
反应后溶液中: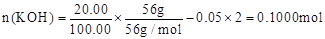
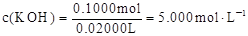 ?(其它合理解法也给分)】
?(其它合理解法也给分)】
本题解析:(1)正极发生还原反应,正极主要反应物所含元素化合价一定降低,总反应中氧元素由0价降为—2价,硫元素由—2价升为+4价,则放电时正极应通入氧气,负极应通入硫化氢;(2)负极主要反应物→产物是H2S→SO32-;根据化合价升高总数等于失去电子数,则H2S—6e-→SO32-;左右电荷数分别为+6、—2,根据KOH溶液显强碱性及电荷守恒,则H2S—6e-+8OH-→SO32-;根据左右氢或氧原子守恒,则负极反应式为H2S+8OH-—6e-=SO32-+5H2O或2H2S+16OH-—12e-=2SO32-+10H2O;(3)放电时负极消耗OH-,负极区溶液的碱性减弱,因此溶液pH降低;(4)K2SO3、K2SO4都能与Ba(OH)2、BaCl2反应生成白色沉淀,因此检验K2SO4的存在时要排除K2SO3的干扰;K2SO3与HCl易反应,Ba(OH)2的成本较高,因此步骤②中应继续加入足量1mol·L-1HCl,充分反应后再加入几滴0.1 mol·L-1 BaCl2,若有白色沉淀产生,则溶液中含有K2SO4;若无白色沉淀产生,则溶液中没有K2SO4;步骤③的目的是检验K2SO3的存在,先加适量硫酸中和KOH至溶液呈酸性,然后加入适量酸性高锰酸钾溶液,利用K2SO3能使酸性高锰酸钾溶液褪色的性质,如果没有K2SO3,酸性高锰酸钾溶液不褪色;如果褪色,说明存在K2SO3;(5)K2SO3+BaCl2=BaSO3↓+2KCl,K2SO4+BaCl2=BaSO4↓+2KCl,2BaSO3+O2=2BaSO4,则最后所得固体为硫酸钡;n(BaSO4)=11.65g÷233g/mol=0.05000mol,则20mL电解质溶液中n(K2SO3)+n(K2SO4)=0.05000mol,故100mL电解质溶液中n(K2SO3)+n(K2SO4)=0.2500mol;根据硫守恒可知,n(H2S) =0.2500mol;2H2S+3O2+4KOH=2K2SO3+4H2O,根据系数之比等于物质的量之比,则n(KOH) =0.5000mol;电池工作前,n(KOH) =56g÷56g/mol=1.000mol,则电解工作一段时间后剩余的n(KOH)=(1.000—0.5000)mol=0.5000mol,则100mL电解质溶液中c(KOH)=0.500mol÷0.1L=5mol/L。
本题难度:简单
3、选择题 如图所示,将两烧杯用导线按如图所示相 连,Pt、Cu、Zn、C分别为四电极,当闭合开关后,以下表述正确的是 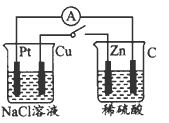
[?]
A.Cu极为原电池负极
B.Cu极附近显碱性
C.G极发生氧化反应
D.电子流向为C极流向Pt极
参考答案:B
本题解析:
本题难度:一般
4、选择题 某同学设计的铜锌原电池如右图所示,则下列说法正确的是
A.因为锌与硫酸锌,铜与硫酸铜不反应,所以该装置无法工作
B.电池反应为:Zn2++Cu=Zn +Cu2+
C.盐桥中的Cl-移向ZnSO4溶液
D.在外电路中,电流从负极流向正极
参考答案:C
本题解析:A、构成原电池的条件是活泼性不同的金属,或金属与非金属,导线相连并插入到电解质溶液中。锌的金属性强于铜。因此根据装置可知,该装置是原电池,可以工作,A不正确;B、锌是负极,铜是正极,溶液中的铜离子得到电子,所以电池反应为Zn+Cu2+=Zn2++Cu,B不正确;C、原电池中负极失去电子,电子沿导线传递到正极。因此溶液中的阳离子向正极移动,则阴离子向负极移动,所以盐桥中的Cl-移向ZnSO4溶液,C正确;D、在外电路中,电流从正极流向负极,D不正确,答案选C。
本题难度:一般
5、选择题 下列装置能够组成原电池并发生原电池反应的是
[? ]
A.
B.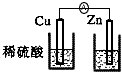
C.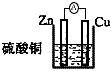
D.
参考答案:C
本题解析:
本题难度:简单