时间:2018-03-17 07:21:14
1、选择题 温度相同、浓度均为0.2mol/L的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤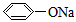 、
、
⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是
[? ]
A. ③①④②⑥⑤
B. ①③⑥④②⑤
C. ③②①⑥④⑤
D. ⑤⑥②④①③
参考答案:A
本题解析:
本题难度:一般
2、选择题 一定温度下,测得某溶液中只含NH4+、Cl-、H+、OH -四种离子,下列说法一定正确的是
[? ]
A.溶液中四种离子之间满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液中离子间满足:c(NH4+)>c(Cl-)>c(OH -)>c(H+),则溶液中溶质为NH3·H2O和NH4Cl
C.若溶液中离子间满足:c(Cl-)>c(NH4+)>c(H+)>c(OH -),则溶液中溶质只有NH4Cl
D.若溶液中c(NH4+) =c(Cl-),则该溶液的pH等于7
参考答案:B
本题解析:
本题难度:一般
3、选择题 等物质的量浓度的下列溶液中,NH4+的浓度最大的是( )
A.NH4Cl
B.NH4HCO3
C.NH4HSO4
D.NH4NO3
参考答案:C
本题解析:
本题难度:简单
4、选择题 关于浓度均为0.1?mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是?
[? ]
?A.c(NH4+):③>①?
?B.水电离出的c(H+):②>①?
?C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)?
?D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列溶液中各微粒的浓度关系不正确的是?
[? ]
A.0.1?mol/LHCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1?L?0.1?mol/L?CuSO4·(NH4)2SO4·6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C.0.1?mol/L?NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
参考答案:D
本题解析:
本题难度:一般