时间:2018-03-17 07:11:29
1、填空题 【化学与技术】
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题: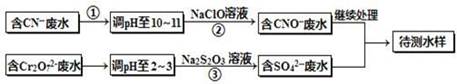 ?
?
(1)上述处理废水流程中主要使用的方法是______。
(2)②中反应后无气体放出,该反应的离子方程式为?。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为?。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因?。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeII[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是_______。
A.x ="0.5" ,a =8
B.x =0.5,a = 10
C.x =" 1.5" ,a =8
D.x =" 1.5" ,a = 10
参考答案:(1)氧化还原法
(2)CN-+ClO-=CNO-+Cl-
(3)3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O
(4)Cu2++2OH-=Cu(OH)2↓? Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq)
因为:KSP(CuS)<KSP[Cu(OH)2]?
(5)D
本题解析:(1)由图可知,将废水中的离子实现上述转化时,利用了氧化还原反应,则主要使用的方法为氧化还原法;
(2)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-,
(3)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为:
3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O。
(4)因铜离子与氢氧根离子反应生成氢氧化铜沉淀,CuS比Cu(OH)2更难溶,则加入Na2S溶液能发生沉淀的转化,故答案为:待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq)。
(5)设最终生成了ymol混合物,由于Cr元素量不变,则有(2-x)y=2,Fe元素不变,则有(1-x)y=a,铁失去的电子物质的量等于Cr得到的电子的物质的量相等,有x=1.5,y=4,a=10。答案选D。
本题难度:一般
2、填空题 化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题: (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)
(1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)
参考答案:
本题解析:
本题难度:困难
3、选择题 下列说法正确的是?( )
A.电离平衡常数受溶液浓度的影响
B.电离常数大的酸溶液中c(H+)一定比电离常数小的酸溶液中的大
C.电离平衡常数可以表示弱电解质的相对强弱
D.H2CO3的电离常数表达式:K=
参考答案:C
本题解析:电离平衡常数只受温度的影响,A错误;浓度相同时电离常数大的酸溶液中c(H+)一定比电离常数小的酸溶液中的大,B错误;H2CO3的电离常数表达式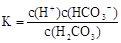 ,D项错误。答案选C。
,D项错误。答案选C。
点评:电离平衡常数只与温度有关,温度变则K变,温度不变则K不变。
本题难度:简单
4、选择题 已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12,某溶液中含有C1-, Br- 和CrO42-,浓度均为0.010mo1·L-,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.C1-、Br-、CrO42-
B.CrO42-、Br-、C1-
C.Br-、C1-、CrO42-
D.Br-、CrO42-、C1-
参考答案:C
本题解析:生成AgCl沉淀所需Ag+的浓度为:c(Ag+)= =
= = 1.56×10-8 mol·L-1
= 1.56×10-8 mol·L-1
生成AgBr沉淀所需Ag+的浓度为:c(Ag+)= =
=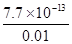 = 7.7×10-11 mol·L-1
= 7.7×10-11 mol·L-1
生成Ag2CrO4沉淀所需Ag+的浓度为:c(Ag+)=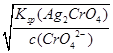 =
=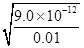 =3.0×10-5 mol·L-1
=3.0×10-5 mol·L-1
根据计算可知,三种离子产生沉淀的先后顺序为Br-、Cl-、CrO42-,故C正确。
考点:了解难溶电解质的沉淀溶解平衡。了解溶度积的含义及其表达式,能进行相关的计算。
点评:在一定温度下,在难溶化合物的饱和溶液中组成沉淀的各离子的浓度的乘积是一常数,称溶度积常数。运用Ksp的公式进行计算,只要注意到AgCl、AgBr和Ag2CrO4的Ksp表达式不同,计算银离子的浓度即可。
本题难度:一般
5、选择题 (1)某温度(t℃)时,测得0.01 mol·L-1?的NaOH溶液的pH=13,请回答下列问题:
①该温度下水的Kw=??。
②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb=??。
(2)已知25°C时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液PH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为?.?
参考答案:(1)①1.0×10-15?②10:1?(2)1.8×10-7mol/L。
本题解析:(1)①0.01 mol·L-1?的NaOH溶液的pOH=2,即pOH+ pH=15,即该温度下水的Kw=1.0×10-15?;
②所得混合液为中性即氢离子的物质的量与氢氧根离子的物质的量相等;即,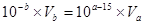 ,又a=12,b=2,则Va︰Vb=10:1;
,又a=12,b=2,则Va︰Vb=10:1;
(2)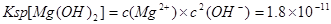 ;当溶液PH=12时即
;当溶液PH=12时即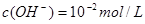 ,代入
,代入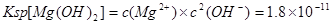 进而可得此时溶液中Mg2+的物质的量浓度为1.8×10-7mol/L。
进而可得此时溶液中Mg2+的物质的量浓度为1.8×10-7mol/L。
本题难度:简单