时间:2018-03-17 07:07:01
1、选择题 常温下,将amol/L的MOH(可溶性弱碱)与bmol/L的盐酸等体积混合,已知相同条件下MOH的电离程度大于M+的水解程度,则下列有关推论不正确的是( ? )
A.若混合后溶液的PH=7,则C(M+)=c(Cl-)
B.若a=2b,则C(M+)>c(Cl-)>c(MOH)>c(OH-)>c(H+)
C.若b=2a,则C(Cl-)>c(M+)>c(H+)>c(OH-)
D.若混合后溶液满足c(H+)=C(OH-)+c(MOH),则可推出a=b
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列物质用途的叙述不正确的是( ? )
A.明矾可用作净水剂
B.氨可用作制冷剂
C.Fe3O4可用作红色油漆和涂料
D.Na2O2可用作呼吸面具中氧气的来源
参考答案:C
本题解析:
本题难度:一般
3、简答题 常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L?HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.请回答下列问题: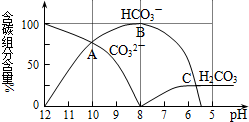
(1)用等式表示Na2CO3溶液中所有阳离子和阴离子浓度的关系:______.
(2)写出Na2CO3溶液中加入少量盐酸的离子方程式______.
(3)当混合液的pH=______时,开始放出CO2气体.
(4)在20mL?0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7?g时开始产生沉淀X,则KSP(X)=______.
参考答案:(1)Na2CO3溶液中存在的阳离子有Na+、H+,阴离子有CO32-、HCO3-、OH-,根据溶液的电中性原则,则有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),
故答案为:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);
(2)Na2CO3溶液中加入少量盐酸生成HCO3-,反应的离子方程式为CO32-+H+=HCO3-,故答案为:CO32-+H+=HCO3-;
(3)当溶液中H2CO3达到饱和后,开始放出CO2气体,由图象可以看出,当PH=6时,H2CO3达到饱和,开始放出CO2气体,故答案为:6;
(4)在20mL?0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7?g时开始产生沉淀BaCO3,此时:c(CO32-)=0.1mol/L,
c(Ba2+)=3.328×10-7g208g/mol0.02L=8.0×10-8,
则:KSP(BaCO3)=c(Ba2+)×c(CO32-)=0.1×8.0×10-8=8.0×10-9
故答案为:8.0×10-9.
本题解析:
本题难度:一般
4、选择题 下列溶液中有关物质的浓度关系正确的是( )
A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.1.0mol/LNa2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
参考答案:A.含有同等浓度的铵根离子的盐中,化学式中含有铵根离子个数越多其浓度越小,硫酸氢铵电离出氢离子抑制铵根离子水解,所以c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c[(NH4)2SO4]<c(NH4HSO4)<c(NH4Cl),故A错误;
B.混合溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(CH3COO-)+c(OH-),所以c(Na+)<c(CH3COO-),故B错误;
C.根据质子守恒得c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C正确;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),故D错误;
故选:C.
本题解析:
本题难度:简单
5、填空题 现有常温下A、B、C、D、E五种盐溶液,分别由K+、NH4+、Ag+、Ba2+、Al3+、Cl-、Br-、CO32-、SO42-
、NO3-中的阳离子和阴离子各一种组成。(五种盐所含阴、阳离子各不相同)
已知:①A+B→白↓ ②A+D→白↓ ③B+C→白↓+气体 ④D+C→白↓ ⑤A溶液中c(H+)=c(OH-)
⑥B溶液中c(H+) =10-12 mol/L ⑦C、D、E三种溶液的pH<7
(1)写出A、D的组成(用分子式表示):A____;D____。
(2)B与C反应的离子方程式为____________。
(3)说明B溶液中c(H+)<c(OH-)的原因是(用文字及相应的离子方程式解释)___________________。
(4)E溶液中各离子浓度由大到小的关系是____________________。
参考答案:(1) BaCl2;AgNO3
(2)2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
(3)溶液中CO32-发生水解反应CO32-+H2O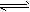 HCO3-+OH-,使溶液呈碱性,所以c(H+)<c(OH-)
HCO3-+OH-,使溶液呈碱性,所以c(H+)<c(OH-)
(4)c(Br-)>c(NH4+)>c(H+)>c(OH-)
本题解析:
本题难度:一般