时间:2018-03-17 06:58:10
1、选择题 对于核电荷数为37的元素,下列描述正确的是
A.原子半径比钾原子半径小
B.其单质常温下跟水反应不如Na剧烈
C.碳酸盐易溶于水
D.氢氧化物不能使Al(OH)3溶解
参考答案:C
本题解析:37号元素的核外电子排布为2、8、18、8、1,所以在第5周期ⅠA族,为RB其性质与Na、K相似,且在钾的下面.K比Na的性质活泼,Rb应更活泼;Rb与水反应比K剧烈,原子半径比K大,RbOH的碱性比KOH强,Rb2CO3比K2CO3更易溶于水.K比Na弱的性质,Rb应更弱:熔点比K低,密度比K大.
本题难度:困难
2、选择题 下列各组物质的性质比较,正确的是( )
A.酸性:HClO4>H2SO4>H3PO4
B.氢化物稳定性:H2S>HF>H2O
C.碱性:NaOH>Mg(OH)2>Ca(OH)2
D.氧化性:F2>Cl2>Br2>I2
参考答案:A、非金属性Cl>S>P,所以最高价氧化物对应水化物的酸性HClO4>H2SO4>H3PO4,故A正确;
B、非金属性F>O>S,氢化物的稳定性HF>H2O>H2S,故B错误;
C、金属性Ca>Na>Mg,所以最高价氧化物对应水化物的碱性Ca(OH)2>NaOH>Mg(OH)2,故C错误;
D、非金属性F>Cl>Br>I,单质结构相似,非金属性越强,单质的氧化性越强,所以氧化性F2>Cl2>Br2>I2,故D正确.
故选:AD.
本题解析:
本题难度:简单
3、推断题 X、Y、Z、M是周期表前四周期中的四种常见元素,原子序数依次增大,其相关信息如下表
(1)2位于周期表第____周期第____ 族。Y、Z的氧化物稳定性较强的是_________ (写化学式)。
(2)X与氢可形成一种原子个数比为1:1的化合物,相对分子质量为78,该分子中存在___个σ键。H-X、 H-Y、H-Z三种共价键中,键长最长的是____
(3)M元素基态原子的电子排布式是____________
(4)已知下列数据:
M(s)+1/2Z2(g)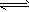 MZ(s):△H= -272 kJ/mol
MZ(s):△H= -272 kJ/mol
2M(s) +3/2Z2(g)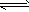 M2Z3(s) △H=-824.2 kJ/mol
M2Z3(s) △H=-824.2 kJ/mol
MZ转化为M2Z3的热化学方程式是_____________________
参考答案:(1)2;ⅥA;H2O
(2)12;H-C
(3)1s22s22p63s23p63d64s2
(4)2MZ(s)+1/2Z2(g)=M2Z3(s) △H = -280.2 kJ/mol
本题解析:
本题难度:一般
4、选择题 下列各组元素中,电负性依次减小的是
A.K、Na、Al
B.O、Cl、H
C.As、P、H
D.O、S、Cl
参考答案:B
本题解析:非金属性越强,电负性越大,金属性越弱,电负性越大。所以答案选B。
本题难度:困难
5、选择题 下列关于元素周期表的说法错误的是( )
A.元素周期表是元素周期律的具体表现形式
B.是先有元素周期律,再有元素周期表的
C.中学课本上的元素周期表是常用的一种形式,也是唯一的一种形式
D.元素周期律是指元素的性质随着原子序数的递增而呈周期性的变化的规律
参考答案:A.周期表是按照原子序数大小排列的,每一周期具有相同的电子层数,每一族元素的价电子数目相等,性质相似,同时按照原子序数的递增呈周期性变化,故A正确;
B.元素周期表是元素周期律的具体表现形式,先有了元素周期律,然后门捷列夫才作出了元素周期表,故B正确;
C.不只有门捷列夫作出了元素周期表,还有别人的不一样的排列方式,故C错误;
D.原子核外电子呈现周期性的变化,所以元素的性质随着原子序数的递增而呈周期性的变化的规律,故D正确.
故选C.
本题解析:
本题难度:一般