时间:2018-03-17 06:57:25
1、选择题 下列说法不正确的是
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质作比较时,Ksp小的,溶解度一定小
参考答案:D
本题解析:对于在一定条件下的一种难溶性的物质来说,当其在水溶液中达到沉淀溶解平衡时,各种离子浓度幂指数乘积是一个常数,这个常数就叫做该物质的溶度积常数。由于物质的溶解度受温度的影响,所以Ksp除了与难溶电解质的性质有关外,还收温度的影响。因此正确。B.ZnS、CuS化学式的组成相似,Ksp(ZnS)>Ksp(CuS),说明ZnS的溶解度比CuS大。当ZnS达到沉淀溶解平衡后,向其水溶液中加入含Cu2+的溶液,ZnS电离产生的S2-会与Cu2+结合产生溶解度更小的CuS沉淀。由于消耗了S2-。破坏了ZnS的沉淀溶解平衡,ZnS继续溶解、电离,产生的S2-再反应产生CuS沉淀。经过一定的时间,ZnS逐渐转变为CuS沉淀。沉淀的颜色由白色转变为黑色。因此ZnS在一定条件下可转化为CuS沉淀。正确。C.对于一个确定的物质来说,其溶度积常数Ksp只与温度有关而与离子的浓度无关。正确。D.溶度积常数是物质达到沉淀溶解平衡时,电离产生的各种离子浓度幂指数的乘积。两种难溶电解质若其形成的化合物阴阳离子的个数比相同(即结构相似)时,Ksp小的,溶解度一定小,但若结构不相似,Ksp小的,溶解度可能大。错误。
本题难度:一般
2、选择题 室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25 ℃其溶度积为2.8×10-9 mol2/L2,下列说法不正确的是
A.x数值为2×10-5
B.c点时有碳酸钙沉淀生成
C.加入蒸馏水可使溶液由d点变到a点
D.b点与d点对应的溶度积相等
参考答案:C
本题解析:A、根据溶度积计算x=2.8×10-9/1.4×10-4=2×10-5,正确,不选A;B、c点离子浓度乘积大于溶度积,所以有碳酸钙沉淀生成,正确,不选B;C、加入蒸馏水,溶度积不变,所以变化沿曲线移动,选C;D、温度没有改变,溶度积不变,正确,不选D。
考点:难溶电解质的溶度积常数
本题难度:一般
3、选择题 已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
参考答案:B
本题解析:A:二者的组成相似,Ksp越大,则c(Mg2+)越大
B:悬浊液中存在溶解平衡,加入NH4Cl后,铵根离子可结合OH—,促进溶解平衡正向进行,c(Mg2+)增大
C:Ksp只和温度有关
D:当悬浊液中c(Mg2+)与加入的F—的浓度乘积大于其Ksp时即可转化为MgF2
本题难度:一般
4、实验题 菱镁矿是碱性耐火材料的主要原料,其主要的化学成分是:MgCO3,同时含有杂质:SiO2、Al2O3、Fe2O3、CaO等;目前以菱镁矿为主要原料制备MgSO4的方法如下:
已知:①常温下,Fe3+、Al3+、Mg2+开始形成氢氧化物沉淀和沉淀完全时的pH值如下:
| ? | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀 | 2.1 | 3.7 | 9.0 |
| 沉淀完全 | 3.2 | 5.2 | 12.4 |
参考答案:(16分)
(1)因NH4++H2O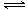 NH3·H2O+H+,MgO+ 2H+=Mg2++H2O,氧化镁消耗氢离子,铵根离子水解平衡向右进行,不断提供H+使MgO不断溶解(3分)(写出两个方程式就给2分,平衡向右移动给1分)
NH3·H2O+H+,MgO+ 2H+=Mg2++H2O,氧化镁消耗氢离子,铵根离子水解平衡向右进行,不断提供H+使MgO不断溶解(3分)(写出两个方程式就给2分,平衡向右移动给1分)
(2)(NH4)2SO4(2分)
(3)250ml容量瓶(2分,没有规格不给分)? K=5.00×10-3 mol?Lˉ1(计算过程见解析)
(4)Fe2O3+ 6NH4+?=6NH3↑+2Fe3++3H2O(条件:加热)(没有写条件和气体呼号扣1分,没配平扣1分;共2分)
(5)避免加热蒸发过程中MgSO4·7H2O失去部分或全部的结晶水(2分)
本题解析:(1)硫酸铵溶液中存在如下水解平衡:NH4++H2O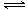 NH3?H2O+H+,氧化镁与氢离子反应,生成镁离子和水,减小氢离子浓度,促进铵根离子的水解平衡右移,生成的氢离子又溶解菱镁矿粉粹后加热生成的氧化镁;(2)步骤③生成硫酸铵,步骤②消耗硫酸铵,说明该工艺流程中,硫酸铵是可以循环利用的物质;(3)配制250mL溶液需要的玻璃仪器是烧杯、玻璃棒、250mL容量瓶、胶头滴管、酸式滴定管等;氨气和硫酸反应所得溶液中含有H+、NH4+、OH-,根据电荷守恒原理可得:c(H+)+c(NH4+)=2c(SO42ˉ),由于pH=1,则溶液中c(H+)=0.1mol/L,c(SO42ˉ)=1.05mol/L,所以c(NH4+)=2.0mol/L;由于(NH4)2SO4=2NH4++SO42ˉ,则没有水解时c(NH4+)="2" c(SO42ˉ)=2.1mol/L;由三行数据法得:
NH3?H2O+H+,氧化镁与氢离子反应,生成镁离子和水,减小氢离子浓度,促进铵根离子的水解平衡右移,生成的氢离子又溶解菱镁矿粉粹后加热生成的氧化镁;(2)步骤③生成硫酸铵,步骤②消耗硫酸铵,说明该工艺流程中,硫酸铵是可以循环利用的物质;(3)配制250mL溶液需要的玻璃仪器是烧杯、玻璃棒、250mL容量瓶、胶头滴管、酸式滴定管等;氨气和硫酸反应所得溶液中含有H+、NH4+、OH-,根据电荷守恒原理可得:c(H+)+c(NH4+)=2c(SO42ˉ),由于pH=1,则溶液中c(H+)=0.1mol/L,c(SO42ˉ)=1.05mol/L,所以c(NH4+)=2.0mol/L;由于(NH4)2SO4=2NH4++SO42ˉ,则没有水解时c(NH4+)="2" c(SO42ˉ)=2.1mol/L;由三行数据法得:
NH4++H2O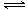 NH3?H2O+H+
NH3?H2O+H+
各组分起始浓度/mol?Lˉ1? 2.1? 0? 0
各组分变化浓度/mol?Lˉ1? 0.1? 0.1? 0.1
各组分平衡浓度/mol?Lˉ1? 2.0? 0.1? 0.1
K=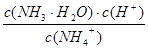 =
=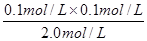 =5.00×10-3 mol?Lˉ1;
=5.00×10-3 mol?Lˉ1;
(4)先写硫酸铵水解反应:NH4++H2O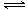 NH3·H2O+H+,再写Fe2O3+6H+=2Fe3++3H2O,前者×6+后者可得:Fe2O3+6NH4++3H2O=6NH3·H2O+2Fe3+,加热时6NH3·H2O
NH3·H2O+H+,再写Fe2O3+6H+=2Fe3++3H2O,前者×6+后者可得:Fe2O3+6NH4++3H2O=6NH3·H2O+2Fe3+,加热时6NH3·H2O  6NH3+6H2O,则Fe2O3+6NH4+=6NH3↑+2Fe3++3H2O;(5)蒸发结晶得到的目标产物是MgSO4·7H2O,加热温度过低,蒸发结晶速率过低,加热温度过高,结晶析出的MgSO4·7H2O失去部分或全部的结晶水,因此蒸发结晶过程中需要使用60~70℃水浴加热方式。
6NH3+6H2O,则Fe2O3+6NH4+=6NH3↑+2Fe3++3H2O;(5)蒸发结晶得到的目标产物是MgSO4·7H2O,加热温度过低,蒸发结晶速率过低,加热温度过高,结晶析出的MgSO4·7H2O失去部分或全部的结晶水,因此蒸发结晶过程中需要使用60~70℃水浴加热方式。
本题难度:困难
5、选择题 下列叙述正确的是
A.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
B.常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小
C.在0.1 mol·L-1 CH3COONa溶液中,c(OH-)>c(CH3COOH)+c(H+)
D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
参考答案:A
本题解析:A、HCl溶液中氢离子的物质的量小于氢氧化钡溶液中氢氧根离子的物质的量,所以溶液显碱性,则溶液中氢氧根离子的浓度=(10×2-10)mL×0.02mol/L/20mL=0.01mol/L,则氢离子的浓度是10-12mol/L,所以溶液的pH=12,正确;B、Ksp也是平衡常数,isUI温度变化而变化,但温度不变,溶度积不变,错误;C、醋酸钠溶液中,醋酸根离子水解生成醋酸和氢氧根离子,所以根据质子守恒,c(OH-)=c(CH3COOH)+c(H+),错误;D、常温下pH=4的NaHC2O4溶液为酸性溶液,则HC2O4-的电离程度大于其水解程度,电离产生C2O42-,水解产生H2C2O4,所以c(H2C2O4)<c(C2O42-),错误,答案选A。
考点:考查酸碱混合pH的计算,溶度积的判断,电解质溶液中离子浓度的判断
本题难度:一般