时间:2018-03-17 06:57:25
1、选择题 一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的PH值 | ≥9.6 | ≥6.4 | 3~4 |
2、填空题 以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。 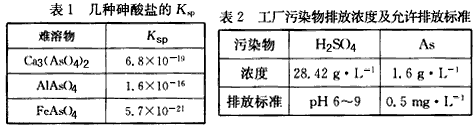
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=________mol/L。
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=_________,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4 mol/L,c(ASO43-)最大为___________mol/L
(3)工厂排放出的酸性废水中的三价砷(H3ASO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷
(H3AsO4弱酸),写出该反应的离子方程式:__________________。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为_______________。
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为___________。
3、填空题 某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1 NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4 mL 2 mol·L-1 HCl 溶液 | 沉淀溶解 |
| Ⅱ | 4 mL 2 mol·L-1 NH4Cl 溶液 | 沉淀溶解 |
4、选择题 有关AgCl沉淀的溶解平衡说法正确的是
A.此时,AgCl沉淀溶解速率为零
B.AgCl难溶于水,溶液中没有Ag+ 和Cl—
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
5、选择题 以MnO2为原料制得的MnCl2溶液中常含有少量Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是( )
A.具有吸附性
B.溶解度与CuS、PbS、CdS等相同
C.溶解度大于CuS、PbS、CdS
D.溶解度小于CuS、PbS、CdS