时间:2018-03-17 06:56:40
1、选择题 现有①NaOH②Al2(SO4)3③Ba(NO3)2 ④CuSO4 ⑤FeCl3⑥淀粉溶液⑦KI 这7种溶液
A.不需外加试剂即可鉴别
B.必须外加试剂才能鉴别
C.如有碘水即能全部鉴别
D.另有一种溶液即可鉴别
参考答案:A
本题解析:CuSO4 溶液为蓝色;FeCl3溶液为棕黄色;以FeCl3溶液为试剂,加入后若有红褐色溶液生成的为NaOH;再以NaOH溶液为试剂,若加入后先有沉淀后沉淀消失的为Al2(SO4)3;再以Al2(SO4)3为试剂,加入后有白色沉淀生成的为Ba(NO3)2 ;将FeCl3溶液加入,若溶液呈黄褐色的为KI溶液,最后为学分溶液;
所以正确选项为A;
本题难度:简单
2、选择题 除去下列物质中少量杂质的方法正确的是
[? ]
A.除去CO2中混有的HCl:用饱和碳酸钠溶液洗气
B.除去NO2中混有的NO:用水洗气
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
参考答案:C
本题解析:
本题难度:一般
3、实验题 )单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。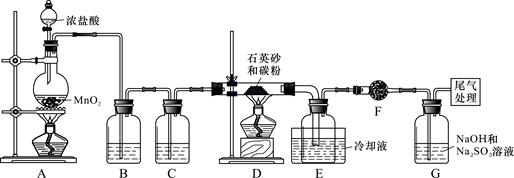
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
| 序号 | 操?作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴?溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴?溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 | ||
| ③ | 向c试管中滴加几滴?溶液 | ? | 假设3成立 |
参考答案:(1)MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O ;SiO2+2C+2Cl2
Mn2++Cl2↑+2H2O ;SiO2+2C+2Cl2 SiCl4+2CO
SiCl4+2CO
(2)浓硫酸;防止生成物中的AlCl3、FeCl3等杂质凝结成固体堵塞导管
(3)【提出假设】假设3:只有ClO-
【设计方案,进行实验】①溴水(或0.01?mol/L?KMnO4溶液)②品红溶液;③淀粉-KI溶液;若溶液变为蓝色
本题解析:(1)装置A中发生的反应是用高锰酸钾和浓盐水在加热的条件下制备氯气,其反应离子方程式MnO2+2Cl-+4H+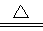 Mn2++Cl2↑+2H2O;氯气经过除杂后在D中和SiO2与C在加热条件下进行反应生成SiCl4和CO,反应化学方程式SiO2+2C+2Cl2
Mn2++Cl2↑+2H2O;氯气经过除杂后在D中和SiO2与C在加热条件下进行反应生成SiCl4和CO,反应化学方程式SiO2+2C+2Cl2 SiCl4+2CO(2)BC中分别为饱和食盐水和浓硫酸用来除去氯气中的HCl和水蒸气;石英砂中的铁、铝等杂质也能转化为相应氯化物,若导管较细使杂质凝结成固体堵塞导管(3)由假设1和假设2得知,要检测的为SO32-和ClO-,故假设3为只有ClO-;又因为SO32-会使KMnO4和溴水,并不与ClO-发生反应,故可以用来检测假设1,而均SO32-和ClO-具有漂白性,会使品红溶液褪色,故可以用来检测假设2;所有试剂中ClO-可以氧化KI使其生成I2,在淀粉溶液中显蓝色,可以用来检测假设3。
SiCl4+2CO(2)BC中分别为饱和食盐水和浓硫酸用来除去氯气中的HCl和水蒸气;石英砂中的铁、铝等杂质也能转化为相应氯化物,若导管较细使杂质凝结成固体堵塞导管(3)由假设1和假设2得知,要检测的为SO32-和ClO-,故假设3为只有ClO-;又因为SO32-会使KMnO4和溴水,并不与ClO-发生反应,故可以用来检测假设1,而均SO32-和ClO-具有漂白性,会使品红溶液褪色,故可以用来检测假设2;所有试剂中ClO-可以氧化KI使其生成I2,在淀粉溶液中显蓝色,可以用来检测假设3。
本题难度:困难
4、选择题 下列装置所示的实验中,能达到实验目的的是: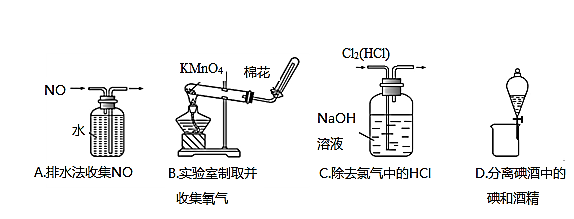
参考答案:A
本题解析:A、NO难溶于水,可用排水法收集,正确;B、O2的密度大于空气,不能用向下排空气法收集,错误;C、NaOH既能与HCl反应,也能与Cl2反应,所以不能用NaOH溶液除去氯气中的HCl,错误;D、碘易溶于酒精,不能用分液法分离碘酒中的碘和酒精,错误。
本题难度:一般
5、选择题 海水资源的利用包括海水的淡化,以下方法中,不能淡化海水的是
A.蒸馏法
B.过滤法
C.电渗析法
D.离子交换法
参考答案:B
本题解析:过滤法只能除去不溶于水的固体物质。所以B选项是错误的
本题难度:简单