时间:2018-03-17 06:55:12
1、填空题 某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.为探究X的成分,他们进行了如下实验.
I.定性检验
| 实验编号 | 实验操作 实验现象 ① 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 ② 向试管1中滴加几滴KSCN溶液,振荡 溶液出现血红色 ③ 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 有极少量红色物质析出,仍有较多黑色固体未溶解 |

参考答案:I.(1)Fe3+能使KSCN溶液呈现血红色,这是Fe3+的特征反应,以此确认Fe3O4的存在.
故答案为:检验是否存在Fe3+,确认Fe3O4的存在
(2)铁能和盐酸反应生成气体,且铁和铜离子发生置换反应生成红色的铜,据此现象判断存在铁;Fe3+能使KSCN溶液呈现血红色,这是Fe3+的特征反应,据此判断Fe3O4的存在.故黑色粉末X为Fe3O4和Fe的混合物.
故答案为:Fe3O4和Fe的混合物
Ⅱ.(1)黑色粉末为铁与Fe3O4,加入过量盐酸可知生成含Fe2+、Fe3+的溶液,再加足量H2O2溶液,使Fe2+氧化为Fe3+,加入氨水生成Fe(OH)3沉淀,操作Z为过滤、洗涤;
灼烧沉淀所用的仪器为坩埚,坩埚下要垫上泥三角.
故答案为:过滤、洗涤;坩埚、泥三角
(2)双氧水有氧化性,二价铁离子有还原性,足量H2O2溶液,使Fe2+氧化为Fe3+,自身含有为H2O,反应的离子方程式为2Fe2++2H++H2O2═2Fe3++2H2O.
故答案为:2Fe2++2H++H2O2═2Fe3++2H2O
(3)设Fe、Fe3O4的物质的量分别为x mol与y mol,
2.480g红棕色Fe2O3固体的物质的量为2.480g160g/mol=0.0155mol,
根据Fe守恒得,x+3y=0.0155×2? ①
由Fe3O4和Fe的混合物2.376g得,56x+232y=2.376?②
联立方程解得,x=0.001;y=0.01
故答案为:n(Fe)=0.001mol;n(Fe3O4)=0.01mol
本题解析:
本题难度:一般
2、实验题 (10分)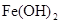 由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用
由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用 ,
,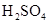 (稀),NaOH溶液可在还原性气氛中制取
(稀),NaOH溶液可在还原性气氛中制取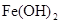 白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象.
白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象.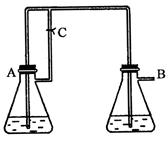
参考答案:铁和稀硫酸 氢氧化钠溶液
①打开弹簧夹C;A中气体由导管进入B,B中有气泡;目的是为了排尽装置和溶液中的氧气,形成还原性气氛;
②过一段时间,关闭弹簧夹C;A中溶液经导管进入B,B中有白色沉淀生成;因为此时A
中压强增大,使得反应生成的FeSO4溶液进入B,而和NaOH反应,生成Fe(OH)2沉淀。
本题解析:要产生还原性的气体,应该用铁和稀硝酸反应生成氢气。即A中的试剂是铁和稀硫酸。利用生成的氢气排尽装置中的空气,从而可以防止氢氧化亚铁被氧化。最后利用氢气产生的越强将硫酸亚铁压入氢氧化钠中进行反应,所以B中的试剂是氢氧化钠溶液。具体的操作是①打开弹簧夹C;A中气体由导管进入B,B中有气泡;目的是为了排尽装置和溶液中的氧气,形成还原性气氛。
②过一段时间,关闭弹簧夹C;A中溶液经导管进入B,B中有白色沉淀生成;因为此时A
中压强增大,使得反应生成的FeSO4溶液进入B,而和NaOH反应,生成Fe(OH)2沉淀。
本题难度:一般
3、选择题 把足量的铁粉投入到稀盐酸和氯化铜的混合溶液中,充分反应后,残余固体的质量与原来加入的铁粉质量相等,则原溶液中H+和Cl-的物质的量之比为( )
A.1∶4
B.1∶7
C.1∶8
D.2∶5
参考答案:C
本题解析:设氯化氢和氯化铜的物质的量分别是x和y。则根据方程式Fe+2HCl=FeCl2+H2↑、Fe+CuCl2=FeCl2+Cu可知,(0.5x+y)×56=64y,解得y=3.5x。所以原溶液中H+和Cl-的物质的量之比为x︰(x+2y)=1∶8,答案选C。
本题难度:一般
4、填空题 (11分)下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,H、I、J都为氧化物,C的焰色反应为黄色,M为红褐色固体。
(1)写出: J的结构式 ?,M的化学式?;
?,M的化学式?;
(2)基于反应①原理的化学工业称为?;写出该反应的化学方程式?;
(3)写出K溶液和E反应的离子方程式?;写出F溶液和H反应的离子方程式?;
(4)已知由G分解得到的H、I、J三者的物质的量相等,则G的化学式为?
参考答案:
本题解析:略
本题难度:一般
5、实验题 (16分)在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。某同学利用铁与水蒸气反应后的固体物质进行了如下实验: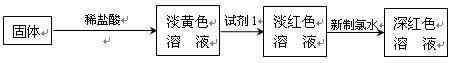
(1)?铁粉与水蒸气反应的化学方程式是: ??
(2)证明还原铁粉与水蒸气发生了反应的方法是??
(3)固体溶于稀盐酸的化学方程式为?。
(4)试剂1的化学式是?。
(5)加入新制氯水后溶液红色加深的原因是(用离子方程式表示)
?;
(6)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色原因进行探究。
①提出假设:
假设1:溶液中的+3价铁被氧化为更高的价态;
假设2:??;
②设计方案:
为了对你所提出的假设2进行验证,实验方案是?
?。
参考答案:(16分)(l) 3Fe+4H2O(g)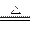 ?Fe3O4+4H2↑(3分)
?Fe3O4+4H2↑(3分)
(2)检验是否有H2产生(2分)
(3) Fe3O4 + 8HCl==2FeCl3+FeCl2+4H2O(3分)
( 4)KSCN(1分)
4)KSCN(1分)
(5)2Fe2++Cl2=2Fe3++2Cl-?(3分)
(6)①假设2:SCN-被过量的氯水氧化(2分)
②取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2 正确,若不变红,则假设2不正确。 (2分)
(2分)
本题解析:略
本题难度:一般