时间:2018-03-17 06:54:04
1、选择题 【南海中学2008届高三化学第一次月考】将下列物质分别加到溴水中,振荡后,因发生化学变化而使溴水褪色的是:①硫化钠②氢氧化钠③乙酸④镁粉⑤裂化汽油⑥甲苯
A.①②③⑤
B.②④⑤⑥
C.①②④⑤
D.②③④⑤
参考答案:C
本题解析:硫化钠可以被溴水氧化;氢氧化钠和溴水反应生成无色的盐溶液;镁粉和溴水生成MgBr2;裂化汽油含有烯烃,可以和溴水加成。
本题难度:一般
2、填空题 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布?。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C?B(选填“>”“<”),第一电离能N>O,原因是?。
(3)月球岩石玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为?,其中硫原子采用?杂化,氧原子的价电子排布图为?,任意写出一种SO42-等电子体?。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示。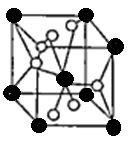
则该氧化物的化学式?(图中钛原子用“O”表示。氧原子用“O”表示)
参考答案:(1)1s22s22p63s23p63d24s2
(2)>? N原子2p上处于半充满状态,比较稳定,所以第一电离能N>O
(3)正四面体;sp3?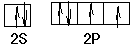 ?CCl4或ClO4-或S2O32-或PO43-
?CCl4或ClO4-或S2O32-或PO43-
(4)TiO2
本题解析:(1)Ti是22元素,核外电子排布式是1s22s22p63s23p63d24s2
(2)非金属性越强,电负性越大,所以电负性C大于B;N原子2p上处于半充满状态,比较稳定,所以第一电离能N>O;
(3)SO42-是AB4型,原子的孤对电子对数是(6+2-4×2)/2=0,所以立体构型是正四面体,采取sp3杂化;氧原子价电子是6,其价电子排布图是, ,与SO42-互为等电子体是5个原子,价电子数是32个,因而符合的有CCl4或ClO4-或S2O32-或PO43-;
,与SO42-互为等电子体是5个原子,价电子数是32个,因而符合的有CCl4或ClO4-或S2O32-或PO43-;
(4)O的个数是4×1/2+2=4,Ti的个数是8×1/8+1=2,该晶体的化学式为TiO2。
本题难度:一般
3、填空题 铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第IB 族。Cu2+的核外电子排布式为________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该品胞中阴离子的个数为_____________。 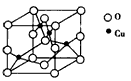
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如喜爱图所示: 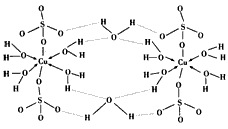
下列说法正确的是_______(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+ 配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因___________________________。
参考答案:(1)[Ar]3d9或1s22s22p63s23p63d9
(2)4个
(3)BD
(4)F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子
(5)高;Cu2O与Cu2S相比,阳离子相同,阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高
本题解析:
本题难度:一般
4、选择题 短周期元素W、X、Y、Z?的原子序数依次增大,W与Y,X与Z位于同一主族.W与X可形成共价化合物WX2.Y原子的内层电子总数是其最外层电子数的2.5倍,Y的单质常作为半导体材料.下列叙述中不正确的是( )
A.W、X、Y、Z分别为C、O、Si、S
B.WX2和ZX2的化学键类型相同
C.Z的气态氢化物比Y的稳定
D.原子半径大小顺序为X<W<Y<Z
参考答案:D
本题解析:
本题难度:一般
5、选择题 已知X、Y、Z、W四种短周期元素(均非稀有气体元素)在周期表中的相对位置如右图所示,下列说法正确的是( )
A.Z元素的原子半径可能比Y元素的小
B.Z元素的最高化合价可能比Y元素的高
C.W形成的单质的熔点一定高于Y
D.Z的最高价氧化物的水化物的酸性一定比W的强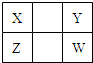
参考答案:A、Z元素比Y多一个电子层,原子核外电子层数越多,半径越大,或根据原子半径的递变规律分析,同一主族从上到下原子半径逐渐增大,则Z>X,同一周期从左到右原子半径逐渐减小,则X>Y,所以Z>Y,故A错误;
B、如Y为F元素,则物最高正价,最高化合价为0价,则Z元素的最高化合价可能比Y元素的高,故B正确;
C、如Y为C元素,形成的单质的晶体类型为原子晶体,如金刚石,则熔点大于W形成的晶体的熔点,故C错误;
D、同周期元素的非金属性从左到右逐渐增强,对应的最高价氧化物的水合物的酸性逐渐增强,则Z的最高价氧化物的水化物的酸性一定比W的弱,故D错误.
故选B.
本题解析:
本题难度:简单